Cepivo proti covidu-19
Cepivo proti covidu-19 (protikovidno cepivo) je cepivo, namenjeno zagotavljanju pridobljene imunosti proti SARS-CoV-2, virusu, ki povzroča koronavirusno bolezen 2019 (covid-19). Pred pandemijo covida-19 je obstajalo ustaljeno znanje o strukturi in delovanju koronavirusov, ki povzročajo bolezni, kot sta hudi akutni respiratorni sindrom (SARS) in bližnjevzhodni respiratorni sindrom (MERS), kar je v začetku leta 2020 omogočilo pospešen razvoj različnih tehnologij cepljenja.[1] Dne 10. januarja 2020 so bili podatki o genetskem zaporedju virusa SARS-CoV-2 posredovani prek GISAID, do 19. marca pa je svetovna farmacevtska industrija napovedala pomembno zavezo k obvladovanju covida-19.[2]
V poskusih III. faze je več cepiv proti covidu-19 pokazalo kar 95-odstotno učinkovitost pri preprečevanju simptomatskih okužb s covidom-19. Od aprila 2021 je vsaj en nacionalni regulatorni organ za javno uporabo odobril 16 cepiv: dve RNK-cepivi (Pfizer-BioNTech in Moderna), sedem konvencionalnih inaktiviranih cepiv (BBIBP-CorV, CoronaVac, Covaxin, WIBP-CorV, CoviVac, Minhai-Kangtai in QazVac), pet virusnih vektorskih cepiv (Sputnik Light, Sputnik V, Oxford-AstraZeneca, Convidecia in Janssen) in dve cepivi z beljakovinskimi podenotami (EpiVacCorona in RBD-Dimer). Skupaj je od marca 2021 v različnih fazah razvoja 308 kandidatov za cepiva, od tega je 73 v kliničnih raziskavah, vključno s 24 v preskušanju I. faze, 33 v preskušanju I.–II. faze in 16 v razvoju III. faze.[3]
Številne države so uvedle načrte postopnega razdeljevanja, ki dajejo prednost tistim z največjim tveganjem za zaplete, kot so starejši, in tistim z velikim tveganjem izpostavljenosti in prenosa, kot so zdravstveni delavci.[4] Razmišlja se o vmesni uporabi enega odmerka, da bi cepljenje zajelo čim več ljudi, dokler se razpoložljivost cepiva ne izboljša.[5][6][7]
Na podlagi uradnih poročil nacionalnih zdravstvenih agencij je bilo do 22. maja 2021 po vsem svetu uporabljenih 1,65 milijarde odmerkov cepiv proti covidu-19.[8] Družba AstraZeneca predvideva, da bo leta 2021 proizvedla 3 milijarde odmerkov, družba Pfizer-BioNTech 1,3 milijarde odmerkov, družbe Sputnik V, Sinopharm, Sinovac in Janssen (v ZDA: Johnson & Johnson) pa po 1 milijardo odmerkov. Družba Moderna namerava leta 2021 proizvesti 600 milijonov odmerkov, družba Convidecia pa 500 milijonov odmerkov.[9] Do decembra 2020 so države vnaprej naročile več kot deset milijard odmerkov cepiva, pri čemer so približno polovico odmerkov kupile države z visokimi dohodki, ki zajemajo 14 % svetovnega prebivalstva.[10][11]
Ozadje
[uredi | uredi kodo]Do razvoja cepiv proti covidu 19 ni bilo poznano učinkovito cepivo proti nobeni bolezni, ki jo povzročajo koronavirusi.[12] Običajno traja razvoj novega cepiva od zasnove do kliničnih preskušanj in naposled pridobitve dovoljenja za promet vsaj desetletje. Eden od omejujočih dejavnikov razvoja so tudi veliki stroški raziskav. Pandemija covida 19 je zaradi svojih uničujočih posledic močno pospešila razvoj cepiva, zlasti ker so ga financirale države in same prevzele finančna tveganja. Ob tem pa ostajajo vsa pravila za pridobitev dovoljenj cepiv enaka.[13] Potreba po čimprejšnji dostopnosti cepiva je povzročila tudi pojav novih platform za cepiva, ob sicer splošno uveljavljenih cepiv na osnovi oslabljenega ali inaktiviranega virusa in virusnih komponent. Tako so se pojavila vektorska cepiva in cepiva na osnovi RNK.[14]
Prvo cepivo, ki so ga nekatere zahodne agencije za zdravila dovolile za uporabo v izjemnih razmerah,[15][16] ter prvo odobreno cepivo s strani teh agencij[17] je postalo RNK-cepivo, ki ga je razvilo podjetje BioNTech v sodelovanju s Pfizerjem. Evropska agencija ga je odobrila decembra 2020,[18] torej v manj kot enem letu od izbruha pandemije.
Vrste cepiv
[uredi | uredi kodo]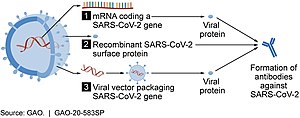
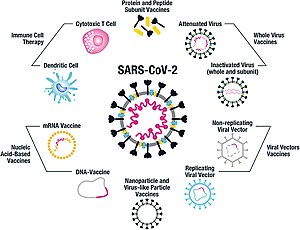
Cepiva, ki so jih razvili oziroma jih razvijajo proti covidu 19, lahko razvrstimo v več vrst, glede na uporabljeno tehnologijo oziroma tako imenovano platformo.[20][21] Večina tehnologij temelji na konični beljakovini virusa SARS-CoV-2 kot na temeljnem antigenu.[21]
Platforme za razvoj protikovidnih cepiv zajemajo tehnologije na osnovi nukleinskih kislin (RNK in DNK), nereplicirajočih virusnih vektorjev, peptidov ali rekombinantnih beljakovin, živih oslabljenih virusov in inaktiviranih virusov.[12][21][22][23]
Več tehnologij za pripravo cepiv, ki so jih razvili z namenom proizvedbe cepiva proti covidu 19, se razlikuje od tehnologij za že poznana cepiva, denimo proti gripi; gre za »naprednejšo generacijo« cepiv, zasnovanih na strategijah tarčnega delovanja na mehanizem okužbe.[21][22][23] Več sinteznih cepiv vključuje mutacijo 2P v konični beljakovini, s čimer se beljakovino »zaklene« v njeni prefuzijski konfiguraciji; s tem se izzove imunski odziv proti virusu, še preden se ta pričvrsti na človeško celico.[24] Nove tehnologije razvoja cepiv bi lahko omogočila tudi lažjo prilagajanje cepiv antigenskim mutacijam ter zagotavljala dobro učinkovitost tudi pri podskupinah ljudi, kot so zdravstveni delavci, starostniki, otroci, nosečnice in bolniki z oslabelim imunskim sistemom.[21][22]
RNK-cepiva
[uredi | uredi kodo]
RNK-cepivo vsebuje RNK, ki po vnosu v telo deluje kot sporočilna RNK (mRNK) in na osnovi katere se v telesnih celicah tvori tuja beljakovina, ki sproži pridobljeni imunski odziv. Pogosto gre za mRNK s spremenjenimi nukleozidi. Molekule RNK so vgrajene v lipidne nanodelce – v njih je RNK zaščitena, hkrati pa se lažje absorbira v celice.[25][26][27][28]
Gre za vrsto cepiv, ki je prva prejela dovoljenja za uporabo v Evropski uniji, Veliki Britaniji in ZDA.[29][30] Junija 2021 sta bili v Evropski uniji odobreni dve protikovidni RNK-cepivi: tozinameran (podjetij Pfizer in BioNTech)
Vektorska cepiva
[uredi | uredi kodo]Med vektorska cepiva spadajo cepiva na osnovi nereplicirajočih virusov; pri razvoja cepiva uporabijo adenovirusno ovojnico, ki vsebuje DNK z zapisom za beljakovino virusa SARS-CoV-2.[37][38] Cepiva proti covidu 19 na osnovi virusnih vektorjev se ne razmnožujejo, torej ne proizvajajo novih virusnih delcev. V telesu povzročijo le proizvodnjo antigena, za katerega zapis nosi DNK v cepivu in ki sproži imunski odziv.[37]
Odobrena (a ne vsa v EU) vektorska cepiva so cepivo proti COVID-19 AstraZeneca,
Pri cepljenju s cepivom Convidecia in cepivom proti COVID-19 Janssen zadošča en odmerek, kar poenostavi logistični vidik cepljenja. Prav tako se lahko več mesecev shranjujeta v običajnih hladilnikih.[45][46]
Cepivo Sputnik V je sestavljeno iz dveh adenovirusnih vektorjev; pri prvem odmerku se uporabi adenovirus 26 (Ad26), ki je enak kot pri cepivu podjetja Janssen, cepivo v drugem odmerku pa vsebuje adenovirus 5 (Ad5), ki ga vsebuje tudi cepivo Convidecia.[47]
Mrtva (inaktivirana) cepiva
[uredi | uredi kodo]Mrtva (inaktivirana) cepiva sestavljajo virusni delci, vzgojeni v kulturi in nato inaktivirani s postopkom, kot sta segrevanje ali izpostavitev formaldehidu. S tem virusni delci izgubijo sposobnost razmnoževanja, izzovejo pa imunski odgovor.[48]
Primeri odobrenih mrtvih protikovidnih cepiv so kitajski CoronaVac,[49][50][51] BBIBP-CorV
Komponentna cepiva
[uredi | uredi kodo]Komponentna cepiva vsebujejo enega ali več povzročiteljevih antigenov, ne pa celotnega patogenega delca. Antigene pogosto predstavljajo povzročiteljeve beljakovinske podenote, lahko pa tudi kakšno drugo sestavino patogena.[56]
Komponentna cepiva so bila poznana že pred obdobjem covida 19 (na primer proti HPV in virusu influence).[14] Aprila 2021 sta bili odobreni prvi protikovidni komponentni cepivi, in sicer peptidno cepivo EpiVacCorona v Rusiji
Rekombinantna proteinska cepiva proti covidu 19 vsebujejo konično beljakovino (protein S) ali njegove posamezne domene in tako izzovejo tvorbo protiteles, ki se ob okužbi vežejo na omenjeno beljakovino in preprečijo vezavo virusa na gostiteljev receptor ACE2.[14]
Druge vrste cepiv
[uredi | uredi kodo]V razvoju so tudi cepiva, ki uporabljajo še druge tehnologije, in sicer cepiva z virusom podobnimi delci, cepiva na osnovi DNK-plazmidov,[59]
Shenzhen Genoimmune Medical Institute[66]
Razvijajo in preučujejo tudi oralna in intranazalna cepiva (za uporabo v ustih oziroma nosni votlini).[69]
Raziskovalci so tudi preučevali morebiten učinek drugih, nekovidnih cepiv na aktivacijo imunskega sistema in posledično ublažitev okužbe s covidom 19.[70] Poskusi kažejo, da lahko cepivo BCG (proti tuberkulozi) nesprecifično poveča imunski odgovor, vendar ni dokazov, da bi bilo učinkovito proti covidu 19.[71]
Učinkovitost
[uredi | uredi kodo]
Učinkovitost cepiva (angl. vaccine efficacy) pomeni, kakšno je tveganje v nadzorovanem kliničnem preskušanju, da cepljena oseba zboli v primerjavi z necepljenimi posamezniki.[73] 0-odstotna učinkovitost pomeni, da cepivo ne deluje (tveganje je enako kot pri placebu), 50-odstotna učinkovitost pa na primer pomeni, da je v skupini cepljenih posameznikov za pol manj okužb kot v skupini necepljenih (oziroma tistih, ki so prejeli placebo).
Podatkov o učinkovitosti ni možno kar neposredno primerjati, ker različna klinična preskušanja vključujejo posameznike z različnimi značilnostmi in z različnih zemljepisnih območij (kjer so lahko tudi različni sevi virusa).[74] V primeru covida 19 velja ocena, da lahko cepivo z vsaj 67-odstotno učinkovitostjo pomaga upočasniti pandemijo – s predpostavko, da cepivo zagotavlja sterilizirajočo imunost in s tej prepreči širjenje okužbe (podatek o preprečevanju simptomne okužbe ni dober pokazatelj preprečevanja širjenja okužbe, saj lahko bolezen širijo tudi brezsimptomni posamezniki).[75] Evropska agencija za zdravila (EMA) in ameriški Urad za hrano in zdravila (FDA) sta opredelila zahtevano učinkovitost za pridobitev dovoljenja za promet pri vsaj 50 %.[76][77]
Upoštevajoč realistično 75-odstotno precepljenost in podatke o osnovnem reprodukcijskem številu se pričakuje, da bi moralo cepivo izkazovati vsaj 70-odstotno učinkovitost, da bi se lahko preprečilo epidemično širjenje okužbe, ter 80-odstotno učinkovitost za popolno zaustavitev širjenja brez potrebe po dodatnih ukrepih, kot je vzdrževanje medosebne razdalje.[78]
Odobrena cepiva izkazujejo naslednjo učinkovitost:
| Cepivo | Učinkovitost glede na hudost bolezni | Območje preskušanja | Reference | ||
|---|---|---|---|---|---|
| Blaga do zmerna[A] | Huda brez hospitalizacije ali smrti[B] | Huda s hospitalizacijo ali smrtjo[C] | |||
| Oxford–AstraZeneca | ≈ 81 % (60–91 %)[D] | ≈ 100 % (97,5-% IZ, 72–100 %) | ≈ 100 % | mednarodno | [79] |
| ≈ 76 % (68–82 %)[E] | ≈ 100 % | ≈ 100 % | ZDA | [80] | |
| Pfizer–BioNTech | ≈ 95 % (90–98 %)[F] | Ni podatka | Ni podatka | mednarodno | [81] |
| Sputnik V | ≈ 92 % (86–95 %) | ≈ 100 % (94–100 %) | ≈ 100 % | Rusija | [82] |
| BBIBP-CorV | ≈ 78 % (65–86 %) | ≈ 100 %[G] | ≈ 100 %[G] | mednarodno | [83] |
| Moderna | ≈ 94 % (89–97 %)[H] | ≈ 100 %[I] | ≈ 100 %[I] | ZDA | [84] |
| Janssen | ≈ 66 % (55–75 %)[J][K] | ≈ 85 % (54–97 %)[K] | ≈ 100 %[K][L] | mednarodno | [85] |
| ≈ 72 % (58–82 %)[J][K] | ≈ 86 % (−9 do 100 %)[K] | ≈ 100 %[K][L] | ZDA | ||
| ≈ 68 % (49–81 %)[J][K] | ≈ 88 % (8–100 %)[K] | ≈ 100 %[K][L] | Brazilija | ||
| ≈ 64 % (41–79 %)[J][K] | ≈ 82 % (46–95 %)[K] | ≈ 100 %[K][L] | Južna Afrika | ||
| CoronaVac | ≈ 51 %[M] | ≈ 84 % (58–94 %)[M] | ≈ 100 % (56–100 %)[M] | Brazilija | [87][88][89] |
| ≈ 84 % | ≈ 100 % | ≈ 100 % | Turčija | [89] | |
| Covaxin | ≈ 78 % (61–88 %)[M] | ≈ 100 %[M] | ≈ 100 %[M] | Indija | [90][91](nezanesljiv vir) |
| Sputnik Light | ≈ 79 % | Ni podatka | Ni podatka | Rusija | [92](nezanesljiv vir) |
| Convidecia | ≈ 66 %[M] | ≈ 91 %[M] | Ni podatka | mednarodno | [93]}}(nezanesljiv vir) |
| Novavax | ≈ 89 % (75–95 %) | ≈ 100 %[G] | ≈ 100 %[G] | Združeno kraljestvo | [94][95] |
| ≈ 60 % (20–80 %) | ≈ 100 %[G] | ≈ 100 %[G] | Južna Afrika | ||
- ↑ Blagi simptomi: vročina, suh kašelj, utrujenost, bolečina v mišicah, bolečina v sklepih, boleče žrelo, driska, slabost, bruhanje, glavobol, izguba voha, izguba okusa, zamašen nos, izcedek iz nosu, vnetje veznice, izpuščaj, mrzlica, omotica. Zmerni simptomi: blažja pljučnica.
- ↑ Hudi simptomi brez hospitalizacije ali smrtnega izida pri posamezniku zajemajo naslednje hude respiratorne simptome, izražene med mirovanjem in ki so se pojavili kadarkoli med opazovanjem bolnika (poleg prisotne pljučnice, globoke venske tromboze, dispneje, hipoksije, vztrajne bolečine v prsih, anoreksije, zmedenosti ali vročine nad 37 °C, ki pa niso bili dovolj vztrajni oziroma hudi, da bi povzročili hospitalizacijo ali smrt): frekvenca dihanja ≥ 30 vdihov/minuto, srčni utrip ≥ 125 utripov/minuto, saturacija s kisikom (SpO2) ≤ 93 % ob dihanju sobnega zraka (morska višina), razmerje med delnim tlakom kisika v arterijski krvi in deležem vdihanega kisika (PaO2/FiO2) < 300 mmHg.
- ↑ Hudi simptomi, ki so vzrok hospitalizacije ali smrti, so tisti, ki zahtevajo bolnišnično zdravljenje ali povzročijo smrt: dispneja, hipoksija, vztrajna bolečina v prsih, anoreksija, zmedenost, vročina nad 38 °C (100 °F), dihalna odpoved, odpoved ledvic, večorganska odpoved, sepsa, šok.
- ↑ Dvanajst tednov ali več med obema odmerkoma. Pri razmiku, krajšem od šest tednov, so poročali o naslednji učinkovitosti: ≈ 55 % (33–70 %).
- ↑ Štiritedenski razmik med obema odmerkoma. Učinkovitost se nanaša na preprečevanje simptomne oblike covida 19.
- ↑ Blage/zmerne kovidne simptome so v preskušanjih cepiva podjetij Pfizer–BioNTech upoštevali pri podatkih za cepljene osebe le, če so se pojavili najmanj sedem dni po drugem odmerku, ob pozitivnem rtPCR-testu ter ob prisotnosti vsaj enega od naslednjih simptomov: vročina, pojav ali poslabšanje kašlja, pojav ali poslabšanje zadihanosti, mrzlica, pojav ali poslabšanje bolečine v mišicah, izguba voha ali okusa, boleče žrelo, driska ali bruhanje.[81]
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 V raziskavi niso poročali o nobenem primeru.
- ↑ Blage/zmerne kovidne simptome so v preskušanjih cepiva podjetja Moderna upoštevali pri podatkih za cepljene osebe le, če so se pojavili najmanj 14 dni po drugem odmerku, ob pozitivnem rtPCR-testu ter ob prisotnosti vsaj dveh sistemskih simptomov (vročina nad 38 °C, mrzlica, bolečina v mišicah, glavobol, boleče žrelo, pojav prej neprisotne motnje okušanja ali vohanja) ali enega respiratornega simptoma (kašelj, zadihanost ali oteženo dihanje, klinični ali rentgenski dokaz pljučnice).[84]
- ↑ 9,0 9,1 Hudi kovidni simptomi, opredeljeni v kliničnem preskušanju cepiva podjetja Moderna, so zajemali simptome, ki so ustrezali merilom za blage/zmerne simptome ter dodatno še kateremukoli od naslednjih kriterijev: klinični znaki, ki so kazali na hudo sistemsko bolezen, frekvenca dihanja ≥ 30 na minuto, srčna frekvenca ≥ 125 utripov na minuto, SpO2 ≤ 93 % na sobnem zraku (na morski višini) ali PaO2/FiO2 < 300 mm Hg, respiratorna odpoved ali sindrom akutne dihalne stiske (opredeljen s potrebo po oskrbi z visokopretočnim kisikom, neinvazivnem ali mehaničnem predihavanju ali zunajtelesni membranski oksigenaciji), dokazan šok (sistolični krvni tlak < 90 mmHg, diastolični krvni tlak <60 mmHg ali potreba po vazopresorju), pomembna akutna ledvična, jetrna ali nevrološka disfunkcija, namestitev v enoti intenzivne medicine ali smrt. V raziskavah niso poročali o primerih hudih simptomov pri cepljenih posameznikih, v skupini prejemnikov placeba pa je bilo 30 takih primerov (incidenčna stopnja 9,1 na 1000 človek-let).[84]
- ↑ 10,0 10,1 10,2 10,3 Primeri zmerno hude bolezni.
- ↑ 11,00 11,01 11,02 11,03 11,04 11,05 11,06 11,07 11,08 11,09 11,10 11,11 Podatki o učinkovisti vsaj 28 dni po edinem odmerku cepiva Janssen. Podatki o učinkovitosti 14 dni po prejetju odmerka cepiva so nižji.[85]
- ↑ 12,0 12,1 12,2 12,3 V preskušanjih na 19.630 cepljenih posameznikih 28 dni po cepljenju niso poročali o nobenem primeru hospitalizacije ali smrti, v primerjavi s 16 primerih hospitalizacije (incidenčna stopnja 5,2 na 1000 človek-let)[85] in sedmimi primeri smrti, povezanimi s covidom, pri 19.691 posameznikih, ki so prejeli placebo.[86]
- ↑ 13,0 13,1 13,2 13,3 13,4 13,5 13,6 13,7 Ti podatki iz preskušaj III. faze niso bili objavljeni ali strokovno pregledani.
Klinična uspešnost
[uredi | uredi kodo]Klinična uspešnost cepiva pomeni, v kakšnem obsegu cepivo prepreči okužbo, simptome, hospitalizacijo ali smrt zaradi covida 19 v študijah realnih kohort (torej v realnem kliničnem okolju, ne v nadzorovanih preskušanjih, v katerih so razmere optimalne).[96]
| Cepivo | Uspešnost glede na hudost bolezni | Območje preskušanja | Reference | |||
|---|---|---|---|---|---|---|
| Brezsimptomna | Simptomna | Hospitalizacija | Smrt | |||
| Oxford–AstraZeneca | Ni podatka | ≈ 89 % (78–94 %) | Ni podatka | Anglija | [97] | |
| Pfizer–BioNTech | ≈ 85 % (74–96 %) | Ni podatka | Anglija | [98] | ||
| ≈ 90 % (68–97 %) | Ni podatka | ≈ 100 %[i] | ZDA | [99] | ||
| ≈ 92 % (88–95 %) | ≈ 94 % (87–98 %) | ≈ 87 % (55–100 %) | ≈ 97 % | Izrael | [100][101] | |
| Sputnik V | Ni podatka | ≈ 98 % | Ni podatka | Rusija | [102][103] | |
| Moderna | ≈ 90 % (68–97%) | Ni podatka | ≈ 100 %[i] | ZDA | [99] | |
| CoronaVac | Ni podatka | ≈ 65 % | ≈ 87 % | ≈ 86 % | Čile | [104][105] |
| Ni podatka | ≈ 94 % | ≈ 96 % | ≈ 98 % | Indonezija | [106][107] | |
| ≈ 63 % (61,5–64,5 %) | ≈ 93,3 % (92,2–94,4 %) | ≈ 95,25 % (95,2–95,3 %) | Urugvaj | [108] | ||
| ≈ 80 % | ≈ 86 % | ≈ 95 % | Brazilija | [109][110] | ||
Glej tudi
[uredi | uredi kodo]- pandemija koronavirusne bolezni 2019 v Sloveniji
- testiranje za COVID-19
- cepivo proti COVID-19 Moderna
- cepivo Sputnik V COVID-19
Sklici
[uredi | uredi kodo]- ↑ Li, Yen-Der; Chi, Wei-Yu; Su, Jun-Han; Ferrall, Louise; Hung, Chien-Fu; Wu, T.-C. (20. december 2020). »Coronavirus vaccine development: from SARS and MERS to COVID-19«. Journal of Biomedical Science. Zv. 27, št. 1. str. 104. doi:10.1186/s12929-020-00695-2. ISSN 1423-0127. PMC 7749790.
- ↑ Neil (23. februar 2021). »No one is safe unless everyone is safe«. BusinessWorld (v ameriški angleščini). Pridobljeno 23. maja 2021.
- ↑ »COVID-19 vaccine tracker«. vac-lshtm.shinyapps.io. Pridobljeno 23. maja 2021.
- ↑ »Covid-19 vaccine: who are countries prioritising for first doses?«. the Guardian (v angleščini). 18. november 2020. Pridobljeno 23. maja 2021.
- ↑ Plotkin, Stanley A.; Halsey, Neal (27. januar 2021). »Accelerate COVID-19 Vaccine Rollout by Delaying the Second Dose of mRNA Vaccines«. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. doi:10.1093/cid/ciab068. ISSN 1537-6591. PMC 7929065. PMID 33502467.
- ↑ Wang, Xiang (22. april 2021). »Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine«. The New England Journal of Medicine. Zv. 384, št. 16. str. 1577–1578. doi:10.1056/NEJMc2036242. ISSN 1533-4406. PMID 33596350.
- ↑ »Evidence For COVID-19 Vaccine Deferred Dose 2 Boost Timing«. Really Correct (v ameriški angleščini). Pridobljeno 23. maja 2021.
- ↑ »Coronavirus (COVID-19) Vaccinations - Statistics and Research«. Our World in Data. Pridobljeno 23. maja 2021.
- ↑ »Which companies will likely produce the most COVID-19 vaccine in 2021?«. Pharmaceutical Processing World (v ameriški angleščini). 5. februar 2021. Pridobljeno 23. maja 2021.
- ↑ So, Anthony D.; Woo, Joshua (15. december 2020). »Reserving coronavirus disease 2019 vaccines for global access: cross sectional analysis«. BMJ (Clinical research ed.). Zv. 371. str. m4750. doi:10.1136/bmj.m4750. ISSN 1756-1833. PMC 7735431. PMID 33323376.
- ↑ Mullard, Asher (30. november 2020). »How COVID vaccines are being divvied up around the world«. Nature. doi:10.1038/d41586-020-03370-6. ISSN 1476-4687. PMID 33257891.
- ↑ 12,0 12,1 Gates B (30. april 2020). »The vaccine race explained: What you need to know about the COVID-19 vaccine«. The Gates Notes. Arhivirano iz spletišča dne 14. maja 2020. Pridobljeno 2. maja 2020.
- ↑ Ihan, Alojz. »Delovanje cepiv proti covid-19« (PDF). NIJZ. Arhivirano iz prvotnega spletišča (PDF) dne 7. junija 2021. Pridobljeno 7. junija 2021.
- ↑ 14,0 14,1 14,2 Bratkovič, Tomaž, Lunder, Mojca, Lovšin, Nika (2020). Razvoj cepiv proti virusu SARS-CoV-2. Farmacevtski vestnik, letnik 71, številka 2, str. 163-173.
- ↑ »UK medicines regulator gives approval for first UK COVID-19 vaccine« (tiskovna objava). Medicines and Healthcare products Regulatory Agency (MHRA). 2. december 2020. Pridobljeno 2. decembra 2020.
- ↑ Boseley S, Halliday J (2. december 2020). »UK approves Pfizer/BioNTech Covid vaccine for rollout next week«. The Guardian. Pridobljeno 14. decembra 2020.
- ↑ »Swissmedic autorise un premier vaccin contre le coronavirus« (v francoščini). Le Temps. 19. december 2020. Pridobljeno 19. decembra 2020.
- ↑ https://www.ema.europa.eu/en/medicines/human/EPAR/comirnaty, vpogled: 7. 6. 2021.
- ↑ Flanagan, Katie L.; Best, Emma; Crawford, Nigel W.; Giles, Michelle; Koirala, Archana; Macartney, Kristine; Russell, Fiona; Teh, Benjamin W.; Wen, Sophie CH (2020). »Progress and Pitfalls in the Quest for Effective SARS-CoV-2 (COVID-19) Vaccines«. Frontiers in Immunology. 11: 579250. doi:10.3389/fimmu.2020.579250. ISSN 1664-3224. PMC 7566192. PMID 33123165.
- ↑ 20,0 20,1 »COVID-19 vaccine development pipeline (Refresh URL to update)«. Vaccine Centre, London School of Hygiene and Tropical Medicine. 1. marec 2021. Pridobljeno 10. marca 2021.
- ↑ 21,0 21,1 21,2 21,3 21,4 Le TT, Cramer JP, Chen R, Mayhew S (Oktober 2020). »Evolution of the COVID-19 vaccine development landscape«. Nature Reviews. Drug Discovery. 19 (10): 667–668. doi:10.1038/d41573-020-00151-8. PMID 32887942. S2CID 221503034.
- ↑ 22,0 22,1 22,2 Thanh Le T, Andreadakis Z, Kumar A, Gómez Román R, Tollefsen S, Saville M, Mayhew S (Maj 2020). »The COVID-19 vaccine development landscape«. Nature Reviews. Drug Discovery. 19 (5): 305–306. doi:10.1038/d41573-020-00073-5. PMID 32273591.
- ↑ 23,0 23,1 Diamond MS, Pierson TC (Maj 2020). »The Challenges of Vaccine Development against a New Virus during a Pandemic«. Cell Host & Microbe. 27 (5): 699–703. doi:10.1016/j.chom.2020.04.021. PMC 7219397. PMID 32407708.
- ↑ Cross, Ryan (29. september 2020). »The tiny tweak behind COVID-19 vaccines«. Chemical & Engineering News. 98 (38).
- ↑ Krammer F (Oktober 2020). »SARS-CoV-2 vaccines in development«. Nature. 586 (7830): 516–27. Bibcode:2020Natur.586..516K. doi:10.1038/s41586-020-2798-3. PMID 32967006. S2CID 221887746.
- ↑ Park KS, Sun X, Aikins ME, Moon JJ (Februar 2021). »Non-viral COVID-19 vaccine delivery systems«. Advanced Drug Delivery Reviews. 169: 137–51. doi:10.1016/j.addr.2020.12.008. PMC 7744276. PMID 33340620.
- ↑ Kowalski PS, Rudra A, Miao L, Anderson DG (april 2019). »Delivering the Messenger: Advances in Technologies for Therapeutic mRNA Delivery«. Molecular Therapy. 27 (4): 710–728. doi:10.1016/j.ymthe.2019.02.012. PMC 6453548. PMID 30846391.
{{navedi časopis}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Verbeke R, Lentacker I, De Smedt SC, Dewitte H (Oktober 2019). »Three decades of messenger RNA vaccine development«. Nano Today. 28: 100766. doi:10.1016/j.nantod.2019.100766.
- ↑ »COVID-19 ACIP Vaccine Recommendations«. Centers for Disease Control and Prevention (CDC). Pridobljeno 18. februarja 2021.
- ↑ »Safe COVID-19 vaccines for Europeans«. European Commission – European Commission. Pridobljeno 19. februarja 2021.
- ↑ »Regulatory Decision Summary – Pfizer–BioNTech COVID-19 Vaccine«. Health Canada, Government of Canada. 9. december 2020. Pridobljeno 9. decembra 2020.
- ↑ »Study to Describe the Safety, Tolerability, Immunogenicity, and Efficacy of RNA Vaccine Candidates Against COVID-19 in Healthy Adults«. ClinicalTrials.gov. United States National Library of Medicine. 30. april 2020. NCT04368728. Arhivirano iz spletišča dne 11. oktobra 2020. Pridobljeno 14. julija 2020.
- ↑ »A Multi-site Phase I/II, 2-Part, Dose-Escalation Trial Investigating the Safety and Immunogenicity of four Prophylactic SARS-CoV-2 RNA Vaccines Against COVID-19 Using Different Dosing Regimens in Healthy Adults«. EU Clinical Trials Register. European Union. 14. april 2020. EudraCT 2020-001038-36. Arhivirano iz spletišča dne 22. aprila 2020. Pridobljeno 22. aprila 2020.
- ↑ »A Study to Evaluate Efficacy, Safety, and Immunogenicity of mRNA-1273 Vaccine in Adults Aged 18 Years and Older to Prevent COVID-19«. ClinicalTrials.gov. United States National Library of Medicine. 14. julij 2020. NCT04470427. Arhivirano iz spletišča dne 11. oktobra 2020. Pridobljeno 27. julija 2020.
- ↑ Palca J (27. julij 2020). »COVID-19 vaccine candidate heads to widespread testing in U.S.«. NPR. Arhivirano iz spletišča dne 11. oktobra 2020. Pridobljeno 27. julija 2020.
- ↑ https://www.ema.europa.eu/en/human-regulatory/overview/public-health-threats/coronavirus-disease-covid-19/treatments-vaccines/covid-19-vaccines, vpogled: 7. 6. 2021.
- ↑ 37,0 37,1 »What are viral vector-based vaccines and how could they be used against COVID-19?«. GAVI. 2020. Pridobljeno 26. januarja 2021.
- ↑ »Understanding Viral Vector COVID-19 Vaccines«. U.S. Centers for Disease Control and Prevention (CD). 13. april 2021. Pridobljeno 19. aprila 2021.
- ↑ »Investigating a Vaccine Against COVID-19«. ClinicalTrials.gov. United States National Library of Medicine. 26. maj 2020. NCT04400838. Arhivirano iz spletišča dne 11. oktobra 2020. Pridobljeno 14. julija 2020.
- ↑ »A Phase 2/3 study to determine the efficacy, safety and immunogenicity of the candidate Coronavirus Disease (COVID-19) vaccine ChAdOx1 nCoV-19«. EU Clinical Trials Register. European Union. 21. april 2020. EudraCT 2020-001228-32. Arhivirano iz spletišča dne 5. oktobra 2020. Pridobljeno 3. avgusta 2020.
- ↑ O'Reilly P (26. maj 2020). »A Phase III study to investigate a vaccine against COVID-19«. ISRCTN. doi:10.1186/ISRCTN89951424. ISRCTN89951424.
- ↑ Corum J, Carl Z (8. januar 2021). »How Gamaleya's Vaccine Works«. The New York Times. Pridobljeno 27. januarja 2021.
- ↑ »A Study of Ad26.COV2.S in Adults«. ClinicalTrials.gov. 4. avgust 2020. Arhivirano iz spletišča dne 16. septembra 2020. Pridobljeno 23. avgusta 2020.
- ↑ »A Study of Ad26.COV2.S for the Prevention of SARS-CoV-2-Mediated COVID-19 in Adult Participants«. ClinicalTrials.gov. US National Library of Medicine. Arhivirano iz spletišča dne 26. septembra 2020.
- ↑ Johnson C, McGinley L. »Johnson & Johnson seeks emergency FDA authorization for single-shot coronavirus vaccine«. The Washington Post.
- ↑ Cite web
- ↑ Wu S, Zhong G, Zhang J, Shuai L, Zhang Z, Wen Z, in sod. (Avgust 2020). »A single dose of an adenovirus-vectored vaccine provides protection against SARS-CoV-2 challenge«. Nat Commun. 11 (1): 4081. Bibcode:2020NatCo..11.4081W. doi:10.1038/s41467-020-17972-1. PMC 7427994. PMID 32796842.
- ↑ Petrovsky N, Aguilar JC (Oktober 2004). »Vaccine adjuvants: current state and future trends«. Immunology and Cell Biology. 82 (5): 488–496. doi:10.1111/j.0818-9641.2004.01272.x. PMID 15479434. S2CID 154670.
- ↑ »Safety and Immunogenicity Study of Inactivated Vaccine for Prevention of SARS-CoV-2 Infection (COVID-19) (Renqiu)«. ClinicalTrials.gov. United States National Library of Medicine. 12. maj 2020. NCT04383574. Arhivirano iz spletišča dne 11. oktobra 2020. Pridobljeno 14. julija 2020.
- ↑ »Clinical Trial of Efficacy and Safety of Sinovac's Adsorbed COVID-19 (Inactivated) Vaccine in Healthcare Professionals (PROFISCOV)«. ClinicalTrials.gov. United States National Library of Medicine. 2. julij 2020. NCT04456595. Arhivirano iz spletišča dne 11. oktobra 2020. Pridobljeno 3. avgusta 2020.
- ↑ PT. Bio Farma (10. avgust 2020). »A Phase III, observer-blind, randomized, placebo-controlled study of the efficacy, safety, and immunogenicity of SARS-COV-2 inactivated vaccine in healthy adults aged 18–59 years in Indonesia«. Registri Penyakit Indonesia. Pridobljeno 15. avgusta 2020.
- ↑ »A Phase I clinical trial to evaluate the safety, tolerance and preliminary immunogenicity of different doses of a SARS-CoV-2 mRNA vaccine in population aged 18–59 years and 60 years and above«. Chinese Clinical Trial Register. 24. junij 2020. ChiCTR2000034112. Arhivirano iz spletišča dne 11. oktobra 2020. Pridobljeno 6. julija 2020.
- ↑ Russia approves its third COVID-19 vaccine, CoviVac 20 February 2021 www.reuters.com, accessed 11 April 2021
- ↑ »VLA2001 COVID-19 Vaccine«. Precision Vaccinations. 31. december 2020. Pridobljeno 11. januarja 2021.
- ↑ »Dose Finding Study to Evaluate Safety, Tolerability and Immunogenicity of an Inactiviated Adjuvanted Sars-Cov-2 Virus Vaccine Candidate Against Covid-19 in Healthy Adults«. U.S. National Library of Medicine. 30. december 2020. Pridobljeno 11. januarja 2021.
- ↑ »Module 2 – Subunit vaccines«. WHO Vaccine Safety Basics. Arhivirano iz prvotnega spletišča dne 20. marca 2021. Pridobljeno 7. junija 2021.
- ↑ »Study of the Safety, Reactogenicity and Immunogenicity of "EpiVacCorona" Vaccine for the Prevention of COVID-19 (EpiVacCorona)«. ClinicalTrials.gov. United States National Library of Medicine. 22. september 2020. NCT04368988. Pridobljeno 16. novembra 2020.
- ↑ »Evaluation of the Safety and Immunogenicity of a SARS-CoV-2 rS (COVID-19) Nanoparticle Vaccine With/Without Matrix-M Adjuvant«. ClinicalTrials.gov. United States National Library of Medicine. 30. april 2020. NCT04368988. Arhivirano iz spletišča dne 14. julija 2020. Pridobljeno 14. julija 2020.
- ↑ »A prospective, randomized, adaptive, phase I/II clinical study to evaluate the safety and immunogenicity of Novel Corona Virus −2019-nCov vaccine candidate of M/s Cadila Healthcare Limited by intradermal route in healthy subjects«. ctri.nic.in. Clinical Trials Registry – India. 15. december 2020. CTRI/2020/07/026352. Arhivirano iz spletišča dne 22. novembra 2020.
- ↑ »Safety, Tolerability and Immunogenicity of INO-4800 for COVID-19 in Healthy Volunteers«. ClinicalTrials.gov. United States National Library of Medicine. 7. april 2020. NCT04336410. Arhivirano iz spletišča dne 11. oktobra 2020. Pridobljeno 14. julija 2020.
- ↑ »IVI, INOVIO, and KNIH to partner with CEPI in a Phase I/II clinical trial of INOVIO's COVID-19 DNA vaccine in South Korea«. International Vaccine Institute. 16. april 2020. Pridobljeno 23. aprila 2020.
- ↑ »Study of COVID-19 DNA Vaccine (AG0301-COVID19)«. ClinicalTrials.gov. United States National Library of Medicine. 9. julij 2020. NCT04463472. Arhivirano iz spletišča dne 11. oktobra 2020. Pridobljeno 14. julija 2020.
- ↑ »Safety and Immunogenicity Study of GX-19, a COVID-19 Preventive DNA Vaccine in Healthy Adults«. ClinicalTrials.gov. United States National Library of Medicine. 24. junij 2020. NCT04445389. Arhivirano iz spletišča dne 11. oktobra 2020. Pridobljeno 14. julija 2020.
- ↑ »S. Korea's Genexine begins human trial of coronavirus vaccine«. Reuters. 19. junij 2020. Arhivirano iz spletišča dne 11. oktobra 2020. Pridobljeno 25. junija 2020.
- ↑ »Safety and Immunity of Covid-19 aAPC Vaccine«. ClinicalTrials.gov. United States National Library of Medicine. 9. marec 2020. NCT04299724. Arhivirano iz spletišča dne 11. oktobra 2020. Pridobljeno 14. julija 2020.
- ↑ »About Us«. Shenzhen Genoimmune Medical Institute. Arhivirano iz spletišča dne 11. oktobra 2020. Pridobljeno 1. avgusta 2020.
- ↑ »Immunity and Safety of Covid-19 Synthetic Minigene Vaccine«. ClinicalTrials.gov. United States National Library of Medicine. 19. februar 2020. NCT04276896. Arhivirano iz spletišča dne 11. oktobra 2020. Pridobljeno 14. julija 2020.
- ↑ »A Phase I/II Randomized, Multi-Center, Placebo-Controlled, Dose-Escalation Study to Evaluate the Safety, Immunogenicity and Potential Efficacy of an rVSV-SARS-CoV-2-S Vaccine (IIBR-100) in Adults«. ClinicalTrials.gov. United States National Library of Medicine. 1. november 2020. NCT04608305.
- ↑ »Scientists Race to Develop Next Generation of COVID Vaccines«.
- ↑ Johnson CY, Mufson S. »Can old vaccines from science's medicine cabinet ward off coronavirus?«. The Washington Post. ISSN 0190-8286. Pridobljeno 31. decembra 2020.
- ↑ »Bacille Calmette-Guérin (BCG) vaccination and COVID-19«. World Health Organization (WHO). 12. april 2020. Arhivirano iz spletišča dne 30. aprila 2020. Pridobljeno 1. maja 2020.
- ↑ »FDA Briefing Document: Pfizer–BioNTech COVID-19 Vaccine« (PDF). Food and Drug Administration. 10. december 2020. Pridobljeno 1. januarja 2021.
- ↑ Zimmer C (20. november 2020). »2 Companies Say Their Vaccines Are 95% Effective. What Does That Mean? You might assume that 95 out of every 100 people vaccinated will be protected from Covid-19. But that's not how the math works«. The New York Times. Pridobljeno 21. novembra 2020.
- ↑ Branswell H (2. februar 2021). »Comparing three Covid-19 vaccines: Pfizer, Moderna, J&J«. Stat. Pridobljeno 28. februarja 2021.
- ↑ Randolph HE, Barreiro LB (Maj 2020). »Herd Immunity: Understanding COVID-19«. Immunity. 52 (5): 737–741. doi:10.1016/j.immuni.2020.04.012. PMC 7236739. PMID 32433946.
- ↑ »The FDA's cutoff for Covid-19 vaccine effectiveness is 50 percent. What does that mean?«. NBC News. Pridobljeno 8. januarja 2021.
- ↑ »EMA sets 50% efficacy goal – with flexibility – for COVID vaccines«. raps.org. Pridobljeno 8. januarja 2021.
- ↑ Bartsch SM, O'Shea KJ, Ferguson MC, Bottazzi ME, Wedlock PT, Strych U, in sod. (Oktober 2020). »Vaccine Efficacy Needed for a COVID-19 Coronavirus Vaccine to Prevent or Stop an Epidemic as the Sole Intervention«. American Journal of Preventive Medicine. 59 (4): 493–503. doi:10.1016/j.amepre.2020.06.011. PMC 7361120. PMID 32778354.
- ↑ Voysey M, Costa Clemens SA, Madhi SA, Weckx LY, Folegatti PM, Aley PK, in sod. (Marec 2021). »Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials«. Lancet. 397 (10277): 881–891. doi:10.1016/S0140-6736(21)00432-3. PMC 7894131. PMID 33617777.
- ↑ »AZD1222 US Phase III primary analysis confirms safety and efficacy«. Pridobljeno 25. marca 2021.
- ↑ 81,0 81,1 »Pfizer–BioNTech COVID-19 Vaccine – rna ingredient bnt-162b2 injection, suspension«. DailyMed. U.S. National Institutes of Health. Pridobljeno 14. decembra 2020.
{{navedi splet}}: Vzdrževanje CS1: url-status (povezava) - ↑ Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, in sod. (Februar 2021). »Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia«. Lancet. 397 (10275): 671–681. doi:10.1016/S0140-6736(21)00234-8. PMC 7852454. PMID 33545094.
- ↑ Kaabi, Nawal Al; Zhang, Yuntao; Xia, Shengli; in sod. (26. maj 2021). »Effect of 2 Inactivated SARS-CoV-2 Vaccines on Symptomatic COVID-19 Infection in Adults: A Randomized Clinical Trial«. JAMA (v angleščini). doi:10.1001/jama.2021.8565. PMID 34037666. Pridobljeno 26. maja 2021.
- ↑ 84,0 84,1 84,2 »Moderna COVID-19 Vaccine – cx-024414 injection, suspension«. DailyMed. U.S. National Institutes of Health. Pridobljeno 20. decembra 2020.
{{navedi splet}}: Vzdrževanje CS1: url-status (povezava) - ↑ 85,0 85,1 85,2 »Janssen COVID-19 Vaccine – ad26.cov2.s injection, suspension«. DailyMed. U.S. National Institutes of Health. Pridobljeno 15. marca 2021.
{{navedi splet}}: Vzdrževanje CS1: url-status (povezava) - ↑ »FDA Briefing Document: Janssen Ad26.COV2.S Vaccine for the Prevention of COVID-19«. US Food & Drug Administration (FDA). 26. februar 2021. Pridobljeno 1. aprila 2021.
- ↑ »Summary of Clinical Trial Data of Sinovac's COVID-19 Vaccine (CoronaVac)« (tiskovna objava). Sinovac Biotech. 3. april 2021. Pridobljeno 12. aprila 2021.
- ↑ Palacios, Ricardo; Batista, Ana Paula; Albuquerque, Camila Santos Nascimento; Patiño, Elizabeth González; Santos, Joane do Prado; Tilli Reis Pessoa Conde, Mônica; Piorelli, Roberta de Oliveira; Pereira Júnior, Luiz Carlos; Raboni, Sonia Mara; Ramos, Fabiano; Sierra Romero, Gustavo Adolfo (11. april 2021). »Efficacy and Safety of a COVID-19 Inactivated Vaccine in Healthcare Professionals in Brazil: The PROFISCOV Study« (v angleščini). Rochester, NY. SSRN 3822780.
{{navedi časopis}}: Sklic journal potrebuje|journal=(pomoč) - ↑ 89,0 89,1 Toscano, Cristiana (29. april 2021). »Evidence Assessment: Sinovac/CoronaVac COVID-19 vaccine« (PDF). WHO.
{{navedi splet}}: Vzdrževanje CS1: url-status (povezava) - ↑ Kay, Chris (21. april 2021). »Homegrown Indian Covid Vaccine Already in Use Shows 78% Efficacy«. Bloomberg. Pridobljeno 25. aprila 2021.
- ↑ »Ocugen's COVID-19 Vaccine Co-Development Partner, Bharat Biotech, Shares Second Interim Results demonstrating 100% Protection against Severe Disease including Hospitalization« (tiskovna objava). Malvern, Pennsylvania: GlobeNewswire. Ocugen. 21. april 2021. Pridobljeno 26. aprila 2021.
- ↑ »Russia okays single-dose Sputnik Light Covid-19 vaccine, has 79.4% efficacy«. India Today. 6. maj 2021.
- ↑ Peshimam G, Farooq U (8. februar 2021). »CanSinoBIO's COVID-19 vaccine 65.7% effective in global trials, Pakistan official says«. Reuters. Islamabad. Pridobljeno 5. marca 2021.
its single-dose regimen and normal refrigerator storage requirement could make it a favourable option for many countries
- ↑ Wadman M, Cohen J (28. januar 2021). »Novavax vaccine delivers 89% efficacy against COVID-19 in UK – but is less potent in South Africa«. Science. doi:10.1126/science.abg8101.
- ↑ »Novavax COVID-19 Vaccine Demonstrates 89.3% Efficacy in UK Phase 3 Trial«. Novavax Inc. (tiskovna objava). Arhivirano iz prvotnega spletišča dne 6. junija 2021. Pridobljeno 3. marca 2021.
- ↑ »What is the difference between efficacy and effectiveness?«. gavi.org. GAVI. 18. november 2020. Pridobljeno 21. aprila 2021.
- ↑ Predloga:Cite techreport
- ↑ Hall VJ, Foulkes S, Saei A, Andrews N, Oguti B, Charlett A, in sod. (8. maj 2021). »COVID-19 vaccine coverage in health-care workers in England and effectiveness of BNT162b2 mRNA vaccine against infection (SIREN): a prospective, multicentre, cohort study«. The Lancet. 397 (10286): 1725–1735. doi:10.1016/S0140-6736(21)00790-X. ISSN 0140-6736. PMC 8064668. PMID 33901423.
- ↑ 99,0 99,1 »Interim Estimates of Vaccine Effectiveness of BNT162b2 and mRNA-1273 COVID-19 Vaccines in Preventing SARS-CoV-2 Infection Among Health Care Personnel, First Responders, and Other Essential and Frontline Workers – Eight U.S. Locations, December 2020–March 2021«. cdc.gov. 29. marec 2021.
- ↑ Dagan N, Barda N, Kepten E, Miron O, Perchik S, Katz MA, in sod. (24. februar 2021). »BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Mass Vaccination Setting«. New England Journal of Medicine. 384 (15): 1412–1423. doi:10.1056/NEJMoa2101765. PMC 7944975. PMID 33626250.
- ↑ Pfizer (11. marec 2021). »Real-World Evidence Confirms High Effectiveness of Pfizer–BioNTech COVID-19 Vaccine and Profound Public Health Impact of Vaccination One Year After Pandemic Declared«. Pridobljeno 1. aprila 2021.
- ↑ »Russia's Sputnik V vaccine 97.6% effective in real-world study«. Reuters. Moscow. 19. april 2021. Pridobljeno 21. aprila 2021.
- ↑ »Sputnik V demonstrates 97.6% efficacy according to analysis of data from 3.8 million vaccinated persons in Russia making it the most efficient COVID-19 vaccine in the world« (tiskovna objava). Moscow: Russian Direct Investment Fund. 19. april 2021. Arhivirano iz prvotnega spletišča dne 21. aprila 2021. Pridobljeno 21. aprila 2021.
- ↑ »Reporte COVID-19: Vacuna Coronavac Tiene Un 90,3% De Efectividad Para Prevenir El Ingreso a UCI«. Ministerio de Salud - Gobierno de Chile (v španščini). 12. maj 2021.
- ↑ »Coronavirus en Chile: Reporte Minsal 17 de Mayo« (v španščini). 17. maj 2021.
- ↑ Aditya, Arys. »China Sinovac Shot Seen Highly Effective in Real World Study«. www.bloomberg.com. Pridobljeno 15. maja 2021.
{{navedi splet}}: Vzdrževanje CS1: url-status (povezava) - ↑ »Kajian Cepat Kemenkes : Vaksin Sinovac Efektif Cegah Kematian«. Sehat Negeriku (v indonezijščini). 12. maj 2021. Pridobljeno 15. maja 2021.
- ↑ »Mass vaccination creates healthy oasis in Brazilian city«. Reuters. 31. maj 2021. Pridobljeno 2. junija 2021.
- ↑ »Sinovac vaccine restores a Brazilian city to near normal«. Associated Press. 1. junij 2021. Pridobljeno 2. junija 2021.
{{navedi splet}}: Vzdrževanje CS1: url-status (povezava)
Viri
[uredi | uredi kodo]- Funk CD, Laferrière C, Ardakani A (2020). »A Snapshot of the Global Race for Vaccines Targeting SARS-CoV-2 and the COVID-19 Pandemic«. Frontiers in Pharmacology. 11: 937. doi:10.3389/fphar.2020.00937. PMC 7317023. PMID 32636754.
- Kyriakidis NC, López-Cortés A, González EV, Grimaldos AB, Prado EO (Februar 2021). »SARS-CoV-2 vaccines strategies: a comprehensive review of phase 3 candidates«. NPJ Vaccines. 6 (1): 28. doi:10.1038/s41541-021-00292-w. PMC 7900244. PMID 33619260.
- Development and Licensure of Vaccines to Prevent COVID-19: Guidance for Industry (poročilo). U.S. Food and Drug Administration. Junij 2020.
- Ramsay M, ur. (2020). »Chapter 14a: COVID-19«. Immunisation against infectious disease. Public Health England.
Zunanje povezave
[uredi | uredi kodo]- COVID‑19 Vaccine Tracker. Regulatory Focus
- M.I.T. Lecture 10: Kizzmekia Corbett, Vaccines" na YouTubu
- Zgodnji razvoj protikovidnih cepiv (zbornik seminarjev UL FKKT, 2021)
