Acetilen

| |

| |
| Imena | |
|---|---|
| IUPAC ime
etin
| |
| Sistematično ime
etin[1] | |
| Identifikatorji | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.000.743 |
| KEGG | |
| UNII | |
| UN število | 1001 (raztopljen) 3138 (v zmesi z etenom in propenom) |
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| C2H2 | |
| Molska masa | 26,04 g·mol−1 |
| Gostota | 1,097 g/L |
| Tališče | −80,8 °C (−113,4 °F; 192,3 K) trojna točka pri 1,27 atm |
| Sublimacijske okoliščine | −84 °C; −119 °F; 189 K (1 atm) |
| 1,185 g/l pri 20 °C | |
| Topnost (aceton) | ≈ 250 l/l acetona |
| Parni tlak | 44,2 atm (20 °C)[2] |
| Kislost (pKa) | 25[3] |
| Struktura | |
| Oblika molekule | linearna |
| Termokemija | |
| Standardna molarna entropija S |
201 J·mol−1·K−1 |
Std tvorbena
entalpija (ΔfH⦵298) |
+226,88 kJ/mol |
| Podatki o eksplozivu | |
| Občutljivost na tresljaje | pri tlakih nad 100 kPa se lahko vname zaradi udarca |
| Nevarnosti | |
| GHS piktogrami |  
|
| Opozorilna beseda | Pozor |
| H220, H336 | |
| P202, P210, P261, P271, P304, P340, P312, P377, P381, P403, P403, P233, P405, P501 | |
| NFPA 704 (diamant ognja) | |
| 300 °C (572 °F; 573 K) | |
| NIOSH (ZDA varnostne meje): | |
PEL (Dopustno)
|
none[2] |
REL (Priporočeno)
|
C 2500 ppm (2662 mg/m3)[2] |
IDLH (Takojšnja nevarnost)
|
N.D.[2] |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
Acetilen (iz latinskega acetum – kis in grškega ὕλη [hile] - les, snov[4]) ali etin je brezbarven plin s kemijsko formulo C2H2 (CH≡CH). Etin je prvi in najenostavnejši član homologne vrste alkinov.
Zaradi trojne vezi spada k nenasičenim ogljikovodikom. Ogljikova atoma imata po dve sp hibridni orbitali, s katerima tvorita dve σ-vezi (C-C in C-H) in dve nehibridzirani p orbitali, s katerima tvorita dve π-vezi (druga in tretja vez C-C). Vezi H-C≡C-H tvorijo kot 180°, zato je molekula linearna in simetrična in spada v točkovno skupino D∞h.[5]
Acetilen je leta 1836 odkril angleški kemik Edmund Davy. Imenoval ga je "nov vodikov plin", potem pa so na odkritje pozabili. Leta 1860 ga je ponovno odkril francoski kemik Marcellin Berthelot in ga imenoval acetilen.
Etin je pomemben energent, na primer za avtogeno varjenje in rezanje kovin, in industrijska surovina. Ker je pri povišanem tlaku zelo nestabilen in eksploziven, se prevaža v jeklenkah, raztopljen na primer v acetonu (dissous plin) ali dimetilformamidu.[6]
Fizikalne lastnosti
[uredi | uredi kodo]Acetilen je vnetljiv in eksploziven brezbarven plin z rahlo aromatičnim vonjem. Acetilen, proizveden iz kalcijevega karbida, ima zaradi primesi (vodikov sulfid, arzin, fosfin) zelo značilen vonj po česnu. Vonj je pri nizkih koncentracijah slabo zaznaven.
Sinteza
[uredi | uredi kodo]Osnovni surovini za sintezo acetilena sta kalcijev karbonat (apnenec, CaCO3) in premog. Kalcijev karbonat se s kalciniranjem pretvori v kalcijev oksid (žgano ali živo apno, CaO), premog pa s koksanjem v koks (C). Iz zmesi kalcijevega oksida in koksa pri visoki temperaturi nastane kalcijev karbid (CaC):
- CaO + 3C → CaC2 + CO
Kalcijev karbid reagira z vodo, tako da nastane acetilen. Reakcijo je leta 1862 odkril nemški kemik Friedrich Wöhler:
- CaC2 + 2H2O → Ca(OH)2 + C2H2
Sinteza kalcijevega karbida zahteva izredno visoko temperaturo, približno 2000 °C, zato reakcija poteka v električni obločni peči.
Acetilen se lahko proizvaja tudi z nepopolnim zgorevanjem metana s kisikom ali s krekiranjem ogljikovodikov.
Berthelot je znal pripraviti acetilen tudi iz metanola, etanola, etilena in dietil etra, tako da je pare omenjenih reaktantov vodil skozi cev, segreto do rdečega žara. Poleg tega je odkril, da acetilen nastaja pri preskoku električne iskre skozi zmes cianogena (N≡C-C≡N) in vodika. Acetilen je sintetiziral tudi neposredno iz vodika in ogljika v električnem obloku z ogljenimi elektrodami.
Reakcije
[uredi | uredi kodo]- Pri temperaturah preko 400 °C brez prisotnosti kisika pride do termičnega razpada acetilena (piroliza). Glavna produkta razpada sta dimer vinilacetilen (H2C=CH-C≡CH) in benzen (C6H6). Pri temperaturah preko 900 °C so glavni produkt razpada saje.
- Berthelot je bil prvi, ki je dokazal, da iz alifatskih ogljikovodikov lahko nastanejo aromatske spojine. S segrevanjem v stekleni cevi je iz acetilena sintetiziral benzen, ki je vseboval nekaj toluena. Z oksidacijo acetilena je dobil ocetno (etanojsko) in oksalno kislino, z redukcijo pa eten (etilen) in etan.
- S polimerizacijo acetilena s Ziegler-Nattovimi katalizatorji (titanove spojine in aluminijeve organske spojine, na primer (C2H5)3Al) je dobil film poliacetilena. Poliacetilen je veriga ogljikovih atomov, v kateri se izmenjujejo enojne in dvojne vezi in je prvi organski polprevodnik, ki so ga odkrili. Po adiciji joda iz njega nastane izjemno električno prevodna snov.
- V reakciji, ki jo je leta 1881 odkril ruski kemik Mihail Kučerov,[7] se acetilen v prisotnosti živosrebrovih spojin, na primer HgBr2, hidrira v acetaldehid. Pred odkritjem Wackerjevega postopka so na ta način proizvajali acetaldehid tudi industrijsko.[8]
- Acetilen tvori z mnogimi kovinskimi ioni acetilenide. Reakcija poteka s prepihavanjem acetilena skozi raztopino kovinske soli. Srebrov in bakrov acetilenid sta močna eksploziva. Bakrov acetilenid nastaja tudi s kovinskim bakrom in njegovimi zlitinami, zato ti materiali niso primerni za naprave, ki prihajajo v stik z acetilenom.
Reppejeva kemija
[uredi | uredi kodo]Nemški kemik Walter Reppe je odkril, da iz acetilena pri visokih tlakih v prisotnosti kovinskih katalizatorjev nastanejo pomembne industrijske kemikalije:
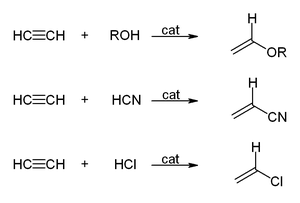
- V reakcijah z alkoholi, vodikovim cianidom, vodikovim kloridom in karboksilnimi kislinami nastajajo vinilne spojine:
- V reakcijah z aldehidi nastajajo etinil dioli:
- Na ta način se iz acetilena in formaldehida (metanal) industrijsko proizvaja 1,4-butindiol:
- HCCH + CH2O → CH2(OH)CCCH2OH
- V reakciji z ogljikovim monoksidom nastanejo akrilna kislina ali njeni estri, ki so surovina za proizvodnjo akrilnega stekla:
- S ciklizacijo acetilena nastaneta benzen in ciklooktatetraen:
Uporaba
[uredi | uredi kodo]V ZDA se približno 80 % acetilena porabi za kemijske sinteze, ostalih 20 % pa za plamensko varjenje in rezanje. Temperatura plamena pri zgorevanju s kisikom je namreč izredno visoka – preko 3300 °C. Pri gorenju se spošča 11,8 kJ/g (57.120 kJ/m3).[9]. Višjo temperaturo plamena imata samo dicianoacetilen (N≡C-C≡C-C≡N, 4990 °C) in cianogen (N≡C−C≡N, 4525 °C).
Acetilen se uporablja tudi v acetilenskih (karbidnih) svetilkah, ki so jih včasih uporabljali rudarji (svetilke ne smemo zamenjati z Davyjevo svetilko), prvi avtomobili in jih še vedno uporabljajo jamarji. V karbidnih svetilkah se acetilen razvija sproti s kapljanjem vode na kalcijev karbid (CaC2), ki je zaprt v spodnjem delu svetilke.
Na začetku 20. stoletja se je acetilen ponekod uporabljal za mestno razsvetljavo.[10] Acetilen se včasih uporablja tudi za ogljičenje jekla, če so obdelovanci preveliki, da bi jih lahko ogljičili v peči.[9] Acetilen se uporablja tudi pri ugotavljanju starosti arheoloških najdb z radiokarbonsko metodo.
Prihodnost
[uredi | uredi kodo]Poraba acetilena bo v prihodnosti postopoma naraščala, predvsem zaradi velikih svetovnih zalog premoga in novih področij uporabe. Ena od novih aplikacij je pretvorba acetilena v etilen in nato v polietilen. V preteklosti se je acetilen, ki nastaja kot stranski produkt pri parnem krekiranju, že uporabljal za poizvodnjo etilena. Novi katalizatorji omogočajo pretvorbo tega acetilena v etilen z veliko večjim izkoristkom in manjšimi stroški.[11]
Varnost
[uredi | uredi kodo]Vplivi na zdravje
[uredi | uredi kodo]Acetilen kot tak ni posebno strupen, če se proizvaja iz kalcijevega karbida pa lahko vsebuje strupene nečistoče kot sta fosfin in arzin, ki dajeta plinu značilen vonj po česnu. Acetilen rahlo draži oči, dihala in kožo. Kronični učinki izpostavljenosti niso znani.
Velike količine acetilena v prostoru izpodrinejo iz zraka kisik in lahko povzročijo zadušitev. Če vsebnost kisika pade pod 19,5 vol %, povzroči omotico, zaspanost, slabost, bruhanje, pretirano slinjenje, zmanjšano budnost, izgubo zavesti in smrt. Izpostavljenost atmosferi z 8-10 vol % ali manj kisika povzroči nezavest brez opozorila in tako hitro, da si posameznik ne more pomagati ali se zaščititi. Pomanjkanje kisika lahko povzroči hude poškodbe ali smrt, v lažji obliki pa depresijo osrednjega živčevja, slabost, glavobol, omotico, bruhanje in neorientiranost. Poškodovanec potrebuje takojšnjo zdravniško pomoč.
Eksplozija in požar
[uredi | uredi kodo]Največja nevarnost je povezana z nestabilnostjo plina, predvsem pri povišanem tlaku. Acetilen lahko eksplozivno razpade, če absolutni tlak plina preseže približno 200 kPa (2 bara). Večina regulatorjev in varnostnih ventilov je zato nastavljena na 100 kPa.[12][13] Acetilen se zato transportira raztopljen v acetonu ali dimetilformamidu (DMF)[14] v jeklenkah napolnjenih s poroznim polnilom. Baker katalizira razpad acetilena, zato se ne sme pretakati po bakrenih ceveh. Medeninaste spojke in ventili niso primerni.
Glej tudi
[uredi | uredi kodo]Sklici
[uredi | uredi kodo]- ↑ Acyclic Hydrocarbons. Rule A-3. Unsaturated Compounds and Univalent Radicals. IUPAC Nomenclature of Organic Chemistry.
- ↑ 2,0 2,1 2,2 2,3 NIOSH Pocket Guide to Chemical Hazards. National Institute for Occupational Safety and Health (NIOSH).
- ↑ Gas Encyclopedia Arhivirano 2022-05-04 na Wayback Machine..
- ↑ R. Wahrig-Burfeind (urednica). Illustriertes Wörterbuch der deutschen Sprache. ADAC-Verlag, München 2004, str. 85. ISBN 3-577-10051-6.
- ↑ C.E. Housecroft, A.G. Sharpe (2008). Inorganic Chemistry (3. izdaja). Prentice Hall. str. 94–95. ISBN 978-0131755536.
- ↑ P. Pässler, W. Hefner, K. Buckl, H. Meinass, A. Meiswinkel, H.-J. Wernicke, G. Ebersberg, R. Müller, J. Bässler, H. Behringer, D. Mayer (2008). Acetylene. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a01_097.pub3. ISBN 3527306730.
- ↑ M. Kutscheroff (1881). Ueber eine neue Methode direkter Addition von Wasser (Hydratation) an die Kohlenwasserstoffe der Acetylenreihe. Berichte der deutschen chemischen Gesellschaft 14: 1540–1542. Kutscheroff, M. Ber. Bunsenges. Phys. Chemie 1881, 1540–1542.
- ↑ D.A. Ponomarev, S.M. Shevchenko (2007). Hydration of Acetylene: A 125th Anniversary Arhivirano 2011-06-11 na Wayback Machine.. J. Chem. Ed. 84 (10, 2007): 1725 }}
- ↑ 9,0 9,1 Acetylene | BOC Gases
- ↑ The 100 most important chemical compounds: a reference guide
- ↑ Acetylene: How Products are Made Arhivirano 2007-01-20 na Wayback Machine..
- ↑ M. Korzun (1986). 1000 słów o materiałach wybuchowych i wybuchu. Warszawa: Wydawnictwo Ministerstwa Obrony Narodowej. ISBN 83-11-07044-X.OCLC 69535236.
- ↑ Acetylene Specification[mrtva povezava]. CFC StarTec LLC. Pridobljeno 2. maja 2012.
- ↑ N.A. Downie (1997). Industrial Gases. London; New York: Blackie Academic & Professional. ISBN 978-0-7514-0352-7.