Voda
| |||
| Imena | |||
|---|---|---|---|
| IUPAC ime
vodikov(I) oksid
| |||
| Druga imena
oksidan, divodikov oksid, voda
| |||
| Identifikatorji | |||
3D model (JSmol)
|
|||
| 3587155 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.028.902 | ||
| Gmelin | 117 | ||
PubChem CID
|
|||
| RTECS število |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| Lastnosti | |||
| H 2O | |||
| Molska masa | 18,01528(33) g/mol | ||
| Videz | brezbarvna tekočina, brez vonja in okusa; brezbarvni plin, trdina, podobna kristalom | ||
| Vonj | brez | ||
| Gostota | Kapljevina:[1] 0,9998396 g/mL pri 0 °C 0,9970474 g/mL pri 25 °C 0,961893 g/mLpri 95 °C Trdnina:[2] 0,9167 g/ml pri 0 °C | ||
| Tališče | 0,00 °C (32,00 °F; 273,15 K) [a] | ||
| Vrelišče | 99,98 °C (211,96 °F; 373,13 K) [3][a] | ||
| N/A | |||
| Topnost | slabo topno v haloalkanih, alifatskih in aromatskih ogljikovodikih ter etrih.[4] Boljša topljivost v karboksilatih, alkoholih, ketonih, aminih. Meša se z metanolom, etanolom, propanolom, izopropanolom, acetonom, glicerolom, 1,4-dioksanom, tetrahidrofuranom, sulfolanom, acetaldehidom, dimetilformamidom, dimetoksietanom, dimetil sulfoksidom, acetonitrilom. Delno se meša z dietil etrom, metil etil ketonom, diklorometanom, etil acetatom in brominom. | ||
| Parni tlak | 3,1690 kilopascal ali 0,031276 atm[5] | ||
| Kislost (pKa) | 13,995[6][7][b] | ||
| Bazičnost (pKb) | 13,995 | ||
| Konjugirana kislina | hidronij | ||
| Konjugirana baza | hidroksid | ||
| Toplotna prevodnost | 0,6065 W/(m·K)[10] | ||
| Lomni količnik (nD) | 1,3330 (20 °C)[11] | ||
| Viskoznost | 0,890 cP[12] | ||
| Struktura | |||
| Kristalna struktura | Heksagonalna | ||
| C2v | |||
| Oblika molekule | ukrivljena | ||
| Dipolni moment | 1,546 D[13] | ||
| Termokemija | |||
| Specifična toplota, C | 75,385 ± 0,05 J/(mol·K)[14] | ||
| Standardna molarna entropija S |
69,95 ± 0,03 J/(mol·K)[14] | ||
Std tvorbena
entalpija (ΔfH⦵298) |
−285,83 ± 0,04 kJ/mol[4][14] | ||
Gibbsova prosta energija (ΔfG˚)
|
−237,24 kJ/mol[4] | ||
| Nevarnosti | |||
| Glavne nevarnosti | utopitev plaz (kot sneg)
| ||
| NFPA 704 (diamant ognja) | |||
| Plamenišče | Negorljivo | ||
| Sorodne snovi | |||
| Drugi kationi | vodikov sulfid vodikov selenid vodikov telurid vodikov polonid vodikov peroksid | ||
| Sorodno topilo | aceton metanol | ||
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |||
| Sklici infopolja | |||
Voda ali sistematično oksidan je anorganska spojina s kemijsko formulo H2O. Je skoraj brezbarvna prozorna snov brez vonja in okusa in glavna sestavina Zemljine hidrosfere in tekočin v vseh znanih živih organizmih, v katerih deluje kot topilo.[15] Voda je bistvenega pomena za vse znane oblike življenja, čeprav nima niti kalorij niti organskih hranil.
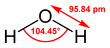
Njena kemijska formula H2O kaže, da njene molekule vsebujejo en kisikov in dva vodikova atoma, povezana s kisikom s kovalentno vezjo. Kot med vodikovima atomoma meri 104,45°.[16] Naziv "voda" se običajno uporablja za vodo v tekočem agregatnem stanju pri standardni temperaturi in tlaku.
Voda ima več agregatnih stanj. V tekočem stanju v ozračju tvori dež in kot aerosol meglo. Oblaki so sestavljeni iz suspendiranih kapljic vode in ledu v njenem trdnem agregatnem stanju. Kristaliziran led lahko pade na zemljo kot sneg. Voda v plinastem agregatnem stanju tvori paro ali vodne hlape.
Voda pokriva približno 70,9 % zemeljske površine, večinoma v morjih in oceanih.[17] Majhen del vode je v podtalnici (1,7 %), ledenikih in ledenih pokrovih Antarktike in Grenlandije (1,7 %), v zraku pa kot para, oblaki, sestavljeni iz ledu in tekoče vode, suspendirane v zraku in padavine (0,001 %).[18][19][20] Voda se nenehno giblje skozi vodni krog izhlapevanja, transpiracije (evapotranspiracije), kondenzacije, padavin in vodotokov, ki običajno dosežejo morje.
Voda igra pomembno vlogo v svetovnem gospodarstvu. Približno 70 % sladke vode, ki jo porabijo ljudje, se porabi v kmetijstvu.[21] Ribolov v slanih in sladkih vodah je glavni vir hrane v številnih delih sveta. Velik del trgovine z blagom na dolge razdalje, kot so nafta, zemeljski plin in industrijski izdelki, se prevaža z ladjami po morjih, rekah, jezerih in kanalih. Velike količine vode, ledu in pare se uporabljajo za hlajenje in ogrevanje v industriji in gospodinjstvih. Voda je odlično topilo za najrazličnejše snovi, tako anorganske kot organske, in se kot taka pogosto uporablja v industrijskih procesih ter pri kuhanju in pranju. Voda, led in sneg so tudi osrednjega pomena za številne športe in druge oblike zabave, kot so plavanje, čolnarjenje, deskanje, športni ribolov, potapljanje, drsanje in smučanje.
Etimologija
[uredi | uredi kodo]Beseda voda izvira iz protoindoevropske besede *wod-or, končnične oblike korena *wed- (»voda«, »mokro«).[22] Preko indoevropskega korena ima podobno ime tudi v drugih jezikih: v grščini ύδωρ (ýdor), v ruščini вода́ (vodá), v irščini uisce in v albanščini ujë.
Lastnosti
[uredi | uredi kodo]Voda je polarna anorganska spojina, pri sobni temperaturi tekočina brez okusa in vonja. Je skoraj brezbarvna z rahlo modrim pridihom. Je najenostavnejši vodikov halkogenid in daleč najbolj preučevana kemijska spojina. Zaradi sposobnosti raztapljanja veliko snovi je opisana kot »univerzalno topilo«.[23][24] Ta lastnost ji omogoča, da je »topilo življenja«.[25] V naravi skoraj vedno vsebuje raztopljene različne snovi, zato so za pridobivanje kemično čiste vode potrebni posebni postopki. Voda je edina običajna snov, ki v normalnih pogojih na Zemlji istočasno obstaja v tekočem, trdnem in plinastem agregatnem stanju.[26]
Stanja
[uredi | uredi kodo]-
Kapljica vode nad vodno površino; tekoča voda
-
Blok ledu
-
Oblaki v zemeljskem ozračju kondenzirajo iz plinastih vodnih hlapov
Spojina s formulo H2O ima dve uradni imeni: voda in oksidan.[27] Voda se imenuje tudi tekoča faza H2O.[28] Drugi dve običajni stanji vode sta trdni led in plinasti hlapi ali para. Dodajanje ali odvzemanje toplote lahko povzroči fazne spremembe: zmrzovanje pretvori vodo v led, taljenje led v vodo, izparevanje vodo v paro, kondenzacija paro v vodo, sublimacija led v paro in depozicija paro v led.[29]
Gostota
[uredi | uredi kodo]Voda se razlikuje od večine tekočin po tem, da se ji po zamrzovanju gostota zmanjša.[30] Med druge snovi s to lastnostjo spadajo tudi bizmut, silicij, germanij in galij. Pri tlaku 1 atm doseže voda svojo maksimalno gostoto 1.000 kg/m3 pri temperaturi 3,98 °C.[31] Gostota ledu je 917 kg/m3, kar pomeni povečanje volumna za približno 9%.[32][33] Ekspanzija lahko povzroči ogromne pritiske, ki povzročajo pokanje vodovodnih cevi in skalovja.[34]
V jezerih in oceanih se voda s temperaturo 4 °C potopi na dno, led pa plava na tekoči vodi in tvori ledeno skorjo. Led kot toplotni izolator prepreči, da bi voda pod njim zmrznila. Brez te zaščite večina vodnih organizmov ne bi preživela zime.[35]
Magnetizem
[uredi | uredi kodo]Voda je diamagnetna snov.[36] S superprevodnimi magneti lahko kljub temu doseže opazno interakcijo.[36]
Fazni prehodi
[uredi | uredi kodo]Pri tlaku 1 atm se led tali ali voda zmrzuje pri 0 °C. Pri enakem tlaku voda vre ali para kondenzira pri 100 °C. Voda lahko prehaja v plinasto fazo tudi pri nižjih temperaturah z izhlapevanjem na površini (vretje je definirano kot izparevanje po celem volumnu). Na površinah se dogajata tudi sublimacija in odlaganje.[29] Primer: zmrzal se odlaga na hladnih površinah, medtem ko snežinke nastanejo z odlaganjem na delce aerosola ali ledeno jedro.[37] V procesu sušenja z zamrzovanjem se živilo zamrzne in nato shrani pri nizkem tlaku, da led na njegovi površini sublimira.[38] Tališče in vrelišče sta odvisna od tlaka. Dober približek odvisnosti temperature tališča od tlaka je Clausius–Clapeyronova enačba:
v kateri sta in molska volumna tkoče in trdne faze, pa molska talilna toplota. V večini snovi se njihov volume med taljenjem povečuje, zato temperatura tališča z naraščajočim tlakom narašča. Ker ima led manjšo gostoto od vode, temperatura tališča z naraščajočim tlakom pada.[30] V ledenikih so v velikih globinah tlaki dovolj visoki, da povzročijo taljenje ledu in nastajanje podledeniških jezer.[39][40]
Clausius-Clapeyronova enačba velja tudi za vrelišče. Ker ima para po prehodu iz tekočine v plin veliko manjšo gostoto kot tekočina, vrelišče s tlakom narašča.[41] V gejzirju Old Faithful v narodnem parku Yellowstone, na primer, temperatura vrelišča preseže 205 °C.[42] V hidrotermalnih oddušnikih lahko temperatura preseže 400 °C.[43]
Na morski gladini je vrelišče vode 100 °C. Z naraščajočo nadmorsko višino zračni tlak pada, zato pada tudi temperatura vrelišča: 1 °C vsakih 274 metrov. Kuhanje na velikih nadmorskih višinah zato traja dlje kot na morju. Na višini okoli 1.500 m, na primer, se čas kuhanja podaljša za četrtino.[44] Velja tudi obratno: z naraščanjem tlaka (lonec na zvišan pritisk) se čas kuhanja skrajša.[45] V vakuumu voda vre pri sobni temperaturi.[46]
Trojna in kritična točka
[uredi | uredi kodo]
Na faznem diagramu tlak/temperatura (glej sliko) so tri krivulje, ki ločujejo trdno fazo od plinaste, plinasto od tekoče in tekočo od trdne. Krivulje se stikajo v tako imenovani trojni točki, v kateri koeksistirajo vse tri faze. Trojna točka je pri temperaturi 273,16 K (0.01 °C) in tlaku 611.657 paskalov (0,00604 atm). [47] Omenjeni tlak je najnižji tlak, pri katerem še lahko obstaja tekoča voda. Do leta 2019 se je trojna točka vode uporabljala za definiranje Kelvinove temperaturne lestvice. [48][49]
Fazna krivulja voda/para se konča pri 647,096 K (373,946 °C) in 22,064 megapaskalih (217,75 atm).[50] Točka je znana kot kritična točka. Pri višjih temperaturah in tlakih tekoča in parna faza vode tvorita neprekinjeno fazo, imenovano superkritična tekočina. Superkritična tekočina se lahko stisne ali ekspandira med plinu podobnimi in tekočini podobnimi gostotami, njene lastnosti, ki se precej razlikujejo od lastnosti vode pri sobnih pogojih, pa so občutljive na gostoto. Pri ustreznih tlakih in temperaturah, na primer, se lahko prosto meša z nepolarnimi spojinami, vključno z večino organskih spojin. Zaradi teh lastnosti postane uporabna za različne aplikacije, vključno z visokotemperaturno elektrokemijo in kot ekološko prijazno topilo ali katalizator v kemijskih reakcijah, v katere so vključene organske spojine. V Zemljinem plašču deluje kot topilo med tvorbo mineralov, raztapljanjem in obarjanjem.[51][52]

Faze ledu in vode
[uredi | uredi kodo]Normalna oblika ledu na zemeljski površini je led Ih, ki kristalizira v heksagonalno kristalno simetrijo.[53] Z naraščanjem tlaka nastaja led z drugimi kristalnimi strukturami. Do leta 2019 je bilo eksperimentalno potrjenih 17 struktur, več drugih pa predvidenih teoretično. [54] Superionska osemnajsta oblika ledu (led XVIII), ploskovno centrirana kocka, je bila odkrita, ko je bila kapljica vode izpostavljena udarnemu valu, ki je povišal tlak na nekaj milijonov atmosfer in temperaturo na nekaj tisoč stopinj. Pri teh pogojih je nastala rešetka togih kisikovih atomov, v kateri so se prosto gibali vodikovi atomi.[55][56] Če je led vgnezden med sloje grafena, tvori kvadratno rešetko.[57]
Podrobnosti kemijske narave tekoče vode niso še povsem dognane. Nekatere teorije nakazujejo, da je nenavadno obnašanje posledica dveh tekočih stanj.[31][58][59][60]
Okus in vonj
[uredi | uredi kodo]Čista voda je običajno opisana kot tekočina brez okusa in vonja, čeprav imajo ljudje specifična čutila, ki zaznavajo prisotnost vode v ustih.[61] Za žabe je znano, da jo lahko zavohajo.[62] Voda iz naravnih virov, vključno z ustekleničeno mineralno vodo, ima običajno veliko raztopljenih snovi, ki ji lahko dajo različne vonje in okuse. Ljudje in živali so razvili čute, ki jim omogočajo oceniti pitnost vode, da bi se izognili preslani ali smrdeči vodi.[63]
Barva in videz
[uredi | uredi kodo]Čista voda je vidno modra zaradi absorbcije svetlobe v območju približno 600 nm – 800 nm.[64] Barvo je mogoče zlahka opaziti v kozarcu vode iz pipe, postavljenem na čisto belo ozadje pri dnevni svetlobi. Glavni absorpcijski pasovi, odgovorni za barvo, so prizvoki razteznih vibracij vezi OH. Navidezna intenzivnost barve narašča z globino vodnega stolpca po Beerovem zakonu. To na primer velja tudi za bazene, če je vir svetlobe sončna svetloba, ki se odbija od belih ploščic bazena.
V naravi se lahko barva spremeni iz modre v zeleno zaradi prisotnosti suspendiranih trdnih snovi ali alg.
V industriji se za vodne raztopine uporablja skoraj infrardeča spektroskopija, saj večja intenzivnost nižjih tonov vode pomeni, da se lahko uporabljajo steklene kivete s kratko dolžino poti. Za opazovanje osnovnega razteznostnega spektra vode ali vodne raztopine v območju okoli 3500 cm−1 (2,85 μm)[65] je potrebna dolžina poti približno 25 μm. Kiveta mora biti pri približno 3500 cm−1 prozorna in netopna v vodi. Za okenca kivet za vodne raztopine se pogosto uporablja kalcijev fluorid.
Ramanovo aktivne osnovne vibracije se lahko opazujejo v 1 cm vzorčni celici.
Vodne rastline, alge in drugi organizmi s fotosintezo lahko živijo v vodi do sto metrov globoko, do koder jih lahko doseže sončna svetloba. Globine pod 1000 metrov sončna svetloba praktično ne doseže.
Lomni količnik tekoče vode pri 20 °C je 1,333 in je veliko večji od lomnega količnika zraka (1,0). Lomni količnik vode je podoben lomnim količnikom alkanov in etanola in nižji od glicerola (1,473), benzena (1,501), ogljikovega disulfida (1,627) in običajnih vrst stekla (1,4 do 1,6). Lomni količnik ledu (1,31) je nekoliko nižji od lomnega količnika tekoče vode.
Polarna molekula
[uredi | uredi kodo]
V molekuli vode tvorita vodikova atoma s kisikovim atomom kot 104,45°. Vodikova atoma sta blizu dveh oglišč tetraedra s kisikovim atomom v središču. V drugih dveh ogliščih sta elektronska para valenčnih elektronov, ki ne sodelujeta v tvorbi vezi. V popolnem tetraedru bi koti merili 109,5°, ker je odboj med osamljenima elektronskima paroma večji od odboja med vodikovima atomoma, a se kot zmanjša na približno 104,5°.[66][67] Dolžina vezi O–H je približno 0,096 nm.[68]
Tetraedrično obliko imajo tudi druge molekule, na primer metan (CH4) in vodikov sulfid (H2S). Ker je kisik bolj elektronegativen (močneje veže svoje elektrone) kot večina drugih elementov, svoje elektrone obdrži, medtem ko sta vodikova atoma pozitivno nabita. Takšen razpored elektronov in upognjenost molekule dajeta molekuli električni dipolni moment in uvrstitev med polarne molekule.[69]
Voda je dobro polarno topilo, ki topi številne soli in hidrofilne organske spojine, kot so sladkorji in enostavni alkoholi, kot je etanol. Voda raztaplja tudi številne pline, kot sta kisik in ogljikov dioksid. Slednji daje mehurčke gaziranim pijačam, penečim vinom in pivu. V živih organizmih so v vodi raztopljene številne snovi, kot so beljakovine, DNK in vodotopni polisaharidi. Interakcije med vodo in podenotami teh biomakromolekul povzročajo zgibanje beljakovin, združevanje baz DNK in druge pojave, ki so ključnega pomena za življenje.
Številne organske snovi, na primer maščobe, olja in alkani, so hidrofobni, se pravi netopni v vodi. Netopne so tudi številne anorganske snovi, vključno z večino kovinskih oksidov, sulfidov in silikatov.
Vodikove vezi
[uredi | uredi kodo]
Molekula vode lahko zaradi svoje polarnosti v tekočem in trdnem stanju tvori štiri vodikove vezi s sosednjimi molekulami vode. Vodikova vez je približno deset krat mošnejša od Van der Waalsove sile, ki privlači molekule v večini tekočin. Vodikove vezi so vzrok, da ima voda veliko višje tališče in vrelišče kot druge analogne spojine, na primer vodikov sulfid. Z njimi je mogoče pojasniti tudi izjemno visoko specifično toploto (okoli 4,2 J/g/K), talilno toploto (ololi 333 J/g), izparilno toploto (2257 J/g) in toplotno prevodnost (med 0,561 in 0,679 W/m/K). Te lastnosti povzročajo, da je voda najučinkovitejši regulator podnebja na Zemlji, ki shranjuje energijo in jo prenaša med oceani in ozračjem. Energija vodikove vezi vode je okoli 23 kJ/mol, se pravi da je približno dvajset krat šibkejša od kovalentne vezi O-H (492 kJ/mol). To pomeni, da je v elektrostatiki udeležena z okoli 90%, preostalih 10% pa prispeva kovalentna vez.[70]
Obe vezi sta vzrok tudi za visoko površinsko napetost vode[71] in kapilarnost. Kapilarnost pomeni tendenco vode, da se dvigne po drobni cevki navzgor v nasprotju z gravitacijo. Ta lastnost je pomembna zlasti za gibanje vode navzgor po žilah v rastlinah, kot so drevesa.[72]
Samoionizacija
[uredi | uredi kodo]Voda je šibka raztopina hidronijevega hidroksida, s katerim je v naslednjem ravnotežju:
- 2 H2O ⇔ H3O+ + OH-
Električna prevodnost
[uredi | uredi kodo]Čista voda ima majhno električno prevodnost, ki se zelo poveča z raztapljanjem že majhnih količin ionskih spojin, na primer kuhinjske soli.
Tekoča voda se z električnim tokom razgradi v njena gradbena elementa kisik in vodik. Proces se imenuje elektroliza. Razgradnja zahteva več energije kot se sprosti toplote v obratnem procesu (285,8 kJ/mol ali 15,9 MJ/kg).[73]
Mehanske lastnosti
[uredi | uredi kodo]Tekoča voda se za večino namenov lahko šteje za nestisljivo. Njena stisljivot se v normaljih pogojih giblje od 4,4 do 5,1×10−10 Pa−1.[74] V oceanih, na primer, se na globini 4.000 m njen volumen zmanjša samo za 1.8 %.[75]
Viskoznost vode pri 20 °C je okoli 10−3 Pa•s ali 0,01 poisa. Hitrost zvoka v vodi je od 1.400 do 1.540 m/s in je odvisna od temperature. Zvok potuje po vodi zelo daleč, zlasti pri nizkih frekvencah. Pri frekvenci 1 kHz njegova jakost pade približno za 0,03 dB/km. To lastnost izkoriščajo kiti in ljudje za sporazumevanje in zaznavanje okolice (sonar).[76]
Reaktivnost
[uredi | uredi kodo]Kovinski elementi, ki so bolj elektropozitivni od vodika, zlasti alkalijske in zemljoalkalijske kovine, kot so litij, natrij, kalij, kalcij in cezij izpodrinejo vodik iz vode in tvorijo hidrokside. Pri visokih temperaturah ogljik reagira z vodno paro, pri čemer nastajata ogljikov monoksid in vodik (vodni plin):
- C + H2O → CO + H2
Voda na Zemlji
[uredi | uredi kodo]Hidrologija je veda, ki preučuje gibanje, porazdelitev in kakovost vode na Zemlji. Preučevanje porazdelitve vode je hidrografija, preučevanje porazdelitve in gibanja podtalnice je hidrogeologija, preučevanje ledenikov glaciologija, površinskih voda limnologija in oceanov oceanografija. Ekološke procese, povezane s hidrologijo, preučuje ekohidrologija.
Skupna masa vode na površini našega planeta, pod njo in nad njo se imenuje hidrosfera. Celotna količina vode v vseh oblikah je približno 1,386 × 109 kubičnih kilometrov.[18] Tekoča voda se nahaja v oceanih, morjih, jezerih, rekah, potokih, kanalih, ribnikih in močvirjih. Večina vode je v oceanih. V trdni, tekoči in plinasti obliki je prisotna tudi v ozračju, pod površino pa kot podzemna voda v vodonosnikih.
Voda je pomembna v številnih geoloških procesih. Talna voda je prisotna v večini kamnin in s svojim tlakom povzroča gubanje površine. Voda v Zemljinem plašču je odgovorna za nastajanje vulkanov v podrivnih conah. Na Zemljini površini sodeluje tako v kemičnih kot fizikalnih procesih preperevanja. Voda in v manjši meri led sta zaslužna tudi za transport ogromne količine sedimentov. Ti tvorijo različne vrste sedimentnih kamnin, ki sestavljajo geološki zapis zgodovine Zemlje.
Kroženje vode
[uredi | uredi kodo]

Vodni ali hidrološki krog je stalno izmenjavanje vode znotraj hidrosfere, med ozračjem, vodo v zemlji, površinsko vodo, podtalnico in rastlinami.
Voda se nenehno giblje skozi vse te regije v vodnem krogu, ki ga sestavljajo naslednji procesi:
- izhlapevanje iz oceanov in drugih vodnih teles v zrak ter transpiracija iz kopenskih rastlin in živali v zrak
- precipitacija vodne pare, ki v zraku kondenzira in pade na zemljo ali v ocean
- odtekanje vode s kopnega, ki večinoma doseže morje
Večina vodnih hlapov, predvsem iz oceana, se vrne vanj, vetrovi pa odnašajo vodne hlape na kopno z enako hitrostjo, kot voda s kopnega odteka v morja. Količina te vode je približno 47 Tt (47 x 1012 ton) letno. Izhlapevanje in transpiracija na kopnem prispevata dodatnih 72 Tt na leto. Padavine na kopnem (119 Tt na leto) imajo več oblik. Najpogostejše so dež, sneg in toča, nekaj pa prispevata tudi megla in rosa.[77] Rosa so majhne kapljice vode, ki kondenzirajo, ko se zelo vlažen zrak sreča s hladno površino. Rosa običajno nastane zjutraj tik pred sončnim vzhodom, ko je temperatura zraka najnižja in ko začne temperatura zemeljske površine naraščati.[78] V zraku kondenzirana voda lahko lomi v svetlobo, da nastane mavrica.
Majhni vodni tokovi se izlivajo v reke. Matematični model, ki se uporablja za simulacijo toka reke ali potoka in izračun parametrov kakovosti vode, je hidrološki transportni model. Nekaj vode se preusmerja v namakanje kmetijskih zemljišč. Reke in morja ponujajo možnosti za potovanja in transport. Vodni tokovi z erozijo oblikuje okolje, ustvarjajo rečne doline in delte, bogatijo zemljo in ravnajo tla za kmetijstvo in gradnjo naselij.
Poplava je dogodek, ko voda iz vodotoka zaradi prevelike količine prestopi bregove in zalije niže ležeče površine. Po drugi strani je suša obdobje, ki lahko traja več mesecev ali let, ko regija trpi zaradi pomanjkanja vode. To se zgodi zaradi podpovprečne količine padavin, bodisi zaradi topografije bodisi zaradi lege na določeni zemljepisni širini.
Vodni viri
[uredi | uredi kodo]Vodni viri so "stoječi" in "tekoči". Voda je lahko shranjena v jezerih, vodni pari, podtalnici ali vodonosnikih ter v ledu in snegu. Od celotne količine svetovne sladke vode je približno 69 odstotkov vode shranjene v ledenikih in trajni snežni odeji, 30 odstotkov v podtalnici in preostali 1 odstotek v jezerih, rekah, ozračju in živih bitjih.[79] Dolžina časa skladiščenja je zelo različna. V nekaterih vodonosnikih je shranjena več tisoč let, v jezerih pa se lahko v sušnih obdobjih manjša in v vlažnih obdobjih veča. V nekaterih regijah precejšen del oskrbe z vodo predstavlja voda, shranjena v zalogah. Če odvzemi presegajo ponovna polnjenja, se zaloge zmanjšajo. Po nekaterih ocenah kar 30 odstotkov celotne vode, porabljene za namakanje, izvira iz netrajnostnega odvzema podzemne vode, kar povzroča izčrpavanje podtalnice.[80]
Morska voda in plimovanje
[uredi | uredi kodo]Morska voda vsebuje v povprečju okoli 3,5 % natrijevega klorida in manjše količine drugih snovi. Fizikalne lastnosti morske vode se v nekaterih pomembnih vidikih razlikujejo od lastnosti sladke vode. Morska voda zmrzne pri nižji temperaturi (okoli −1.9 °C). Njena gostota s padajočo temperaturo narašča, zato svoje maksimalne vrednosti ne doseže pri temperaturi nad lediščem. Slanost morske vode se spreminja od okoli 0,7 % v Baltiku do 4 % v Rdečem morju. V Mrtvem morju, ki je prav za prav jezero, je slanost izjemno visoka in se giblje med 30 in 40 %.
Plimovanje ali bibavica je naraščanje in padanje gladine morja zaradi delovanja Lunine in Sončeve težnosti na oceane. Plimovanje povzroči spremembe globine morskih in estuarskih vodnih teles in tokove, imenovane plimski tokovi. Sprememba vodne gladine na določeni lokaciji je posledica položaja Lune in Sonca glede na Zemljo, vrtenja Zemlje in lokalne batimetrije. Pas morske obale, ki je ob plimi poplavljen in ob oseki kopen, se imenuje medplimno območje in je pomembno naravno okolje.
Vplivi na življenje
[uredi | uredi kodo]
Z biološkega vidika ima voda veliko različnih lastnosti, ki so ključne za nadaljevanje življenja. Voda organskim spojinam omogoča reagiranje na načine, ki na koncu omogočajo reprodukcijo. Vse znane oblike življenja so odvisne od vode. Voda je ključnega pomena kot topilo v številnih telesnih tekočinah in bistveni element številnih presnovnih procesov v telesu. Presnova je vsota anabolizma in katabolizma.
Anabolizem je del presnove, ki zajema izgradnjo telesu lastnih snovi iz manjših molekul. Procesi so praviloma endotermni in oksidativni in potekajo s pomočjo encimov. V teh procesih nastajajo na primer škrobi, trigliceridi in proteini, v katerih so shranjeni energija in informacije.
Katabolizem pomeni razgradnjo presnovnih produktov na enostavnejše molekule. Telo uporablja katabolne procese zlasti za razstrupljanje in pridobivanje energije. Katabolizem je energijsko povezan z anabolizmom: energija, ki nastaja med katabolnimi procesi, se porablja za izgradnjo kompleksnejših molekul v anabolnih procesih. Brez vode ti procesi ne bi bili mogoči.
Voda je bistvena za fotosintezo in dihanje. Celice, v katerih poteka fotosinteza, uporabljajo sončno energijo za razgradnjo vode na kisik in vodik.[81] Nastali vodik reagira z ogljikovim dioksidom, absorbiranim iz zraka ali vode. V procesu nastajata glukoza in kisik. Pri dihanju celic je proces obrnjen: ogljik in vodik se v celicah oksidirata v vodo in ogljikov dioksid, pri čemer se sprošča energija.
Voda je osrednjega pomena tudi za kislinsko-bazično nevtralnost in delovanje encimov. Kislino, ki je donor vodikovega iona (protona H+), se lahko nevtralizira z bazo, ki je acceptor protonov (hidroksidni ion OH−), pri čemer nastaja voda. Voda velja za nevtralno s pH 7. Kisline imajo pH vrednosti manjše od 7, medtem ko imajo baze vrednosti večje od 7.
Življenje v vodi
[uredi | uredi kodo]Površinske vode na Zemlji so polne življenja. Najzgodnejše oblike življenja so se pojavile prav v vodi. Izkjučno v vodi živijo koraj vse ribe, z njo pa so povezani tudi morski sesalci delfini in kiti. Dvoživke preživijo del svojega življenja v vodi in del na kopnem. V vodi rastejo haloge in alge, ki so osnova za nekatere podvodne ekosisteme. Plankton je na splošno temelj oceanske prehranjevalne verige.
Vodni vretenčarji pridobivajo za življenje potreben kisik na različne načine. Ribe imajo namesto pljuč škrge. Nekatere vrste rib, kot je pljučarica, imajo celo oboje. Vodni sesalci, kot so delfini, kiti, vidre in tjulnji, morajo občasno priti na površje in dihati zrak. Nekatere dvoživke lahko absorbirajo kisik skozi svojo kožo. Nevretenčarji imajo široko paleto prilagoditev za preživetje v vodah z majhno vsebnostjo kisika, vključno z dihalnicami (mehkužci) in škrgami (rakovice). Ker se je življenje nevretenčarjev razvilo v vodnem okolju, ima večina malo ali nobene posebne prilagoditve za dihanje v vodi.
-
Biotska raznovrstnost koralnega grebena
-
Nekaj morskih diatomej, ključne skupine fitoplanktona
-
Raki na Von Dammovem hidrotermalnem polju preživijo tudi v spremenjeni kemiji vode
Vpliv na človeštvo
[uredi | uredi kodo]Zgodovinske človeške civilizacije so se razvile ob velikih rečnih tokovih. Mezopotamija, ki se pogosto šteje za zibelko civilizacije, leži med rekama Evfrat in Tigris. Egipčanska civilizacija se je razvila ob Nilu. V Indiji je od leta 3300 pr. n. št. do 1300 pr. n. št. cvetela civilizacija ob Indu in njegovih pritokih s Himalaje. Ob reki (Tibera) je bil ustanovljen tudi Rim.
Velike metropole, kot so Rotterdam, London, Montreal, Pariz, New York, Buenos Aires, Šanghaj, Tokio, Chicago in Hongkong, dolgujejo del svojega uspeha njihovi dostopnosti po vodi in posledični širitvi trgovine. Iz istega razloga so cveteli tudi otoki z varnimi pristanišči, kot je Singapur. V Severni Afriki in na Bližnjem vzhodu, kjer je vode bolj malo, je bil dostop do čiste pitne vode ša kako pomemben dejavnik človekovega razvoja.
Zdravje in onesnaževanje
[uredi | uredi kodo]
Voda, primerna za prehrano ljudi, se imenuje pitna voda. Voda, ki ni pitna, se lahko pretvori v pitno s filtracijo ali destilacijo ali z vrsto drugih metod. Dostopa do zdrave pitne vode nima več kot 660 milijonov ljudi.[82][83]
Voda, neprimerna za pitje, vendar neškodljiva na primer za kopanje, ima več imen, na primer "varna za kopanje". Klor, ki se uporablja za pripravo vode, draži kožo in sluznico. Vsebnost klora, v pitni vodi običajno 1 ppm in v vodi za kopanje običajno 1-2 ppm, je predmet državne regulative. Klor v kopališki vodi pri teh koncentracijah še ne reagira z nečistočami. Za vzdrževaje primerne kakovosti kopališke vode je potrebna dodatna obdelava, na primer s klorovim apnom (Ca(ClO)2), ozonom (O3) ali ultravijolično svetlobo.
Recikliranje vode je proces, v katerem se odpadna voda, predvsem komunalna, pretvori v vodo, uporabno za druge namene.
Sladka voda je obnovljiv vir, ki se obnavlja v naravnem vodnem krogu. Zaradi njene neenakomerne porazdelitve v času in prostoru, se zaradi naraščajočih potreb kmetijstva in industrije ter naraščajočega števila prebivalstva stalno povečujejo pritiski za dostop do nje. Trenutno skoraj milijarda ljudi po vsem svetu nima dostopa do varne in cenovno dostopne vode. Leta 2000 so Združeni narodi določili razvojne cilje tretjega tisočletja za vodo, da bi do leta 2015 prepolovili delež ljudi po vsem svetu brez dostopa do varne vode in sanitarij. Doseganje tega cilja je bilo neenakomerno in leta 2015 so se ZN zavezali k trajnostnemu razvoju, da bi dosegli univerzalni dostop do varne in cenovno dostopne vode in sanitarij do leta 2030. Slaba kakovost vode in slaba higiena sta smrtonosni. Zaradi bolezni, povezanih z vodo, vsako leto umre približno pet milijonov ljudi. Svetovna zdravstvena organizacija ocenjuje, da bi varna voda lahko vsako leto preprečila 1,4 milijona smrti otrok zaradi driske.[84]
V državah v razvoju 90 % komunalne odpadne vode odteka neprečiščene v lokalne vodotoke.[85] Približno 50 držav s približno tretjino svetovnega prebivalstva trpi zaradi srednjega ali velikega pomanjkanja vode. 17 od teh držav letno porabi več vode, kot jo dopolnijo njihovi naravni vodni krogi.[86] Poraba ne vpliva samo na površinska sladkovodna telesa, kot so reke in jezera, ampak uničuje tudi podtalnico.
V letu 2020 je bilo kemijsko stanje površinskih voda v Sloveniji ocenjeno za 94 vodnih teles, od tega za 82 rek, 6 jezer in 6 morskih lokacij. Za matriks voda je bilo kemijsko stanje ocenjeno za 90 vodnih teles. Dobro kemijsko stanje je bilo ugotovljeno za 86 vodnih teles (95,6 %), slabo pa za štiri vodna telesa površinskih voda (4,4 %). Za matriks živi organizmi je bilo kemijsko stanje ocenjeno za 28 vodnih teles in slabo kemijsko stanje je bilo ugotovljeno na vseh vodnih telesih (100%). Rezultati monitoringa kemijskega stanja površinskih voda v Sloveniji namreč v splošnem kažejo, da sta najbolj problematični snovi, ki povzročata slabo kemijsko stanje, živo srebro in bromove spojine v živih organizmih.[87] Splošno ekološko stanje površinskih voda v Sloveniji v letu 2018 ARSO ocenjuje večinoma dobro, kar naj bi veljalo predvsem za obalno morje in v glavnem tudi za vodotoke, čeprav v letu 2018 pridobljene ocene ekološkega stanja na podlagi rib potrjujejo širše prisotno hidromorfološko spremenjenost in splošno degradiranost vodotokov in njihovega zaledja. Zaznali so tudi hidromorfološko spremenjenost in splošno degradiranost Blejskega jezera, kar govori o stopnjevanje pritiskov ob obali jezera, glavni problem zadrževalnikov v severovzhodni Sloveniji pa tudi v letu 2018 ostaja preobremenjenost s hranili (gnojila v kmetijstvu, fosfati v odplakah ipd).[88]
Raba vode
[uredi | uredi kodo]
Kmetijstvo
[uredi | uredi kodo]80 do 90 odstotkov vode, ki jo porabijo ljudje, gre za namakanje v kmetijstvu.[90]
Dostop do sladke vode se pogosto šteje za samoumeven, zlasti v razvitih državah, ki so zgradile sofisticirane sisteme za zbiranje, čiščenje in dovajanje vode ter odstranjevanje odpadnih voda. Čedalje večji gospodarski, demografski in podnebni pritiski povzročajo vse večjo zaskrbljenost zaradi vprašanj, povezanih z vodo. Pritiske še povečujejo naraščajoče število prebivalcev, večanje obdelovalnih površin za pridelavo hrane in biogoriv in industrije z veliko porabo vode.[91]
Raziskavo upravljanja voda v kmetijstvu je leta 2007 izvedel Mednarodni inštitut za upravljanje voda na Šrilanki, da bi ugotovil, ali ima svet dovolj vode za svoje naraščajoče prebivalstvo.[92] Ocenila se je trenutna razpoložljivost vode za kmetijstvo v svetovnem merilu in začrtale lokacije, ki trpijo zaradi pomanjkanja vode. Ugotovilo se je, da petina ljudi na svetu, se pravi več kot 1,2 milijarde, živi na območjih fizičnega pomanjkanja vode, kjer ni dovolj vode za zadostitev vseh potreb. Nadaljnjih 1,6 milijarde ljudi živi na območjih z gospodarskim pomanjkanjem vode, kjer zaradi pomanjkanja naložb v vodo ali nezadostnih človeških zmogljivosti oblasti ne morejo zadovoljiti povpraševanja po vodi. Poročilo ugotavlja, da bi bilo v prihodnosti mogoče pridelati potrebno hrano, vendar bo nadaljevanje današnjega načina proizvodnje hrane in okoljskih trendov povzročilo krize v mnogih delih sveta. Da bi se izognili svetovni vodni krizi, si bodo morali kmetje prizadevati povečati produktivnost za zadostitev naraščajočih potreb po hrani, medtem ko bodo morale industrije in mesta najti načine za učinkovitejšo rabo vode.[93]
Pomanjkanje vode povzročajo tudi proizvodi, ki porabijo veliko količino vode. Za pridelavo 1 kg bombaža, potrebnega za izdelavo približno enih hlač, je potrebnih 10,9 m3 vode. Samo za pridelavo bombaža se porabi 2,4 % svetovne porabe vode. Ogromo škodo za okolje je pridelava bombaža že povzročila. Odvzemanje vode iz Sir Darje in Amu Darje je v veliki meri vzrok za usihanje Aralskega jezera.[94]
-
Poraba vode za tono ali m3 živila
-
Kapljično namakanje
-
Namakanje pridelkov
Voda kot znanstveni standard
[uredi | uredi kodo]7. aprila 1795 je bil v Franciji definiran gram kot "absolutna masa volumna čiste vode, enakega kocki s stranicami 1/100 metra pri temperaturi tališča ledu".[95]
Za bolj praktično rabo je bil potreben kovinski referenčni standard, tisočkrat večji kilogram. V ta namen je bila naročena natančna določitev mase enega litra vode. Kljub dejstvu, da je definicija grama določala vodo pri 0 °C, ki je zelo ponovljiva temperatura, so se znanstveniki odločili, da bodo na novo opredelili standard in svoje meritve opravili pri temperaturi največje gostote vode, ki je bila takrat izmerjena v 4 °C.[96]
Kelvinova temperaturna lestvica sistema SI je temeljila na trojni točki vode, opredeljeni kot natančno 273,16 K (0,01 °C), vendar od maja 2019 temelji na Boltzmannovi konstanti. Kelvinova lestvica je absolutna temperaturna lestvica z enakim prirastkom kot Celzijeva temperaturna lestvica, ki je bila prvotno opredeljena glede na vrelišče vode, nastavljeno na 100 °C, in tališče vode, nastavljeno na 0 °C.
Naravna voda je sestavljena predvsem iz izotopov 1H in 16O, vsebuje pa tudi majhne količine težjih izotopov 18O, 17O in 2H (devterij). Odstotek težjih izotopov je zelo majhen, a kljub temu vpliva na lastnosti vode. Voda v rekah in jezerih običajno vsebuje manj težjih izotopov kot morska voda, zato je standardna voda opredeljena v specifikaciji Dunajske standardne srednje oceanske vode.
Pitna voda
[uredi | uredi kodo]
Človeško telo vsebuje od 55 % do 78 % vode, odvisno od telesne zgradbe.[97] Za pravilno delovanje telo potrebuje od enega do sedem litrov vode na dan, da se izogne dehidraciji. Količina je odvisna od dejavnosti, temperature in vlažnosti zraka in drugih dejavnikov. Večino vode zaužijemo s hrano ali pijačo in seveda s pitjem čiste vode. Natančna količina vode, ki jo mora zaužiti zdrava oseba, ni jasna. British Dietetic Association svetuje, naj se za vzdrževanje pravilne hidracije zaužije 2,5 litra vode dnevno, od tega 1,8 litra neposredno s pitjem.[98] Medicinska stroka zagovarja manjšo količino vode, običajno 1 liter, plus količino, izgubljeno zaradi potenja in vročega vremena.[99]
Zdrave ledvice lahko izločijo od 0,8 do 1 litra vode na uro, vendar stres, kot je vadba, lahko to količino zmanjša. Ljudje med vadbo pogosto pijejo veliko več vode, kot je potrebno, in se s tem izpostavljajo nevarnosti zastrupitve z vodo (hiperhidracija), ki je lahko usodna.[100][101] Zdi se, da priljubljena trditev, da "mora človek zaužiti osem kozarcev vode na dan", nima resnične znanstvene podlage.[102] Študije so pokazale, da je bil dodaten vnos vode, zlasti do 500 mililitrov med obrokom, povezan z izgubo teže.[103][104][105][106][107][108] Ustrezen vnos tekočine pomaga preprečiti zaprtje.[109]

Izvirno priporočilo za dnevni vnos vode, ki ga je objavil Ameriški urad za živila in prehrano leta 1945, pravi, naj bi bila količina vode en mililiter za vsako vnešeno kalorijo hrane. Večino te vode vsebujejo že sama živila.[110] Najnovejše referenčno poročilo o prehranskem vnosu, ki ga je na splošno priporočil Nacionalni raziskovalni svet Združenih držav na podlagi povprečnega skupnega vnosa vode iz podatkov raziskav v ZDA, priporoča dnevni vnos 3,7 litra vode za moške in 2,7 litra za ženske, pri čemer opozarja, da voda v hrani zagotavljala približno 19 % celotnega vnosa vode.[111] Nosečnice in doječe matere potrebujejo dodatno količino vode. Nosečnice bi morale povečati dnevni vnos vode za 0,2 l, doječe matere pa za 0,8 l.[112]
Telo izloča vodo s sečem, znojenjem in dihanjem. Visoke temperature povzročajo dodatno izločanje vode.
Pitna voda vsebuje nekaj nečistoč. Med najpogostejše spadajo kovinske soli in oksidi, vključno s kalcijem, magnezijem, bakrom, železom, manganom in svincem[113] in/ali škodljivimi bakterijami. Nekatere nečistoče so sprejemljive in celo zaželene za izboljšanje okusa in zagotavljanje potrebnih elektrolitov.[114]
Največji posamični vir pitne vode na Zemlji je Bajkalsko jezero v Sibiriji,[115] ki vsebuje 23.615,39 km³ vode.[116]
V poročilu o spremljanju stanja pitnih voda za leto 2020 slovensko ministrstvo za zdravje na osnovi rezultatov izvedenih fizikalnih, -kemijskih in mikrobioloških preskušanj ugotavlja, da naj bi bil delež skladnih vzorcev za mikrobiološke parametre (Escherichia coli in enterokoki) pri manjših vodovodih večji od 94 %, pri večjih vodovodih pa naj bi bil delež skladnih vzorcev večji od 99 %. Podatki kažejo tudi, da je delež vzorcev, odvzetih na oskrbovalnih območjih, kjer se mikrobiološka dezinfekcija ne izvaja (oziroma samo občasno; pomeni, da se v vodo ne dodajajo dezinfekcijski dodatki), na območju celotne Slovenije 24,3 %, na območju posamezne statistične regije pa se delež giblje med 5,8 % (Zasavska Slovenija) in do 52,1 % (Osrednjeslovenska regija). Razlike v deležih so odvisne predvsem od kakovosti vode na viru ter kakovosti in dolžine vodovodnega omrežja.[117]
Umivanje in pranje
[uredi | uredi kodo]Voda lahko tvori raztopine in emulzije in je zato uporabna za različne oblike umivanja in pranja. Umivanje je pomemben vidik osebne higiene, veliko vode pa se porabi tudi za pranje in pomivanje posode. V povprečnem gospodinjstvu razvitega dela sveta se za vse to porabi več sto litrov vode dnevno.
Transport
[uredi | uredi kodo]Prevoz blaga po morju, rekah in kanalih je pomemben del svetovnega gospodarstva.
Izmenjava toplote
[uredi | uredi kodo]Voda in para sta zaradi svoje razpoložljivosti in visoke toplotne kapacitete običajna medija za izmenjavo toplote, tako za hlajenje kot ogrevanje. Hladna voda je v naravi na voljo v jezerih, vodotokih in morju. Zaradi visoke izparilne/kondenzacijske toplote je še posebej učinkovita za prenos toplote z izparevanjem in kondenzacijo vode.
Pomanjkljivost vode je, da kovine, ki se običajno uporabljajo v industriji, na primer jeklo in baker, v neobdelani vodi in pari hitreje oksidirajo. Voda se v skoraj vseh termoelektrarnah uporablja kot delovna tekočina v zaprti zanki med kotlom, parno turbino in kondenzatorjem in kot hladilna tekočina v toplotnih izmenjevalcih in hladilnih stolpih. V ZDA so ravno termoelektrarne največji porabnik hladilne vode.[118]
V jedrskih elektrarnah se voda lahko uporablja tudi kot moderator nevtronov. V večini jedrskih reaktorjev je voda hkrati hladilno sredstvo in moderator. To zagotavlja tudi nekaj pasivne varnosti, saj odstranitev vode iz reaktorja upočasni jedrsko reakcijo. Za zaustavitev jedrske reakcije so primernejše druge metode, zaželeno pa je, da je jedro reaktorja pokrito z vodo, ki zagotavlja ustrezno hlajenje.
Gašenje požarov
[uredi | uredi kodo]
Voda ima visoko izparilno toploto in je relativno nereaktivna in zato primerna tekočina za gašenje požarov. Izhlapevanje vode odvzema ognju toploto. Za gašenje požarov, v katerih gorijo tudi olja in organska topila, je voda nevarna in zato neprimerna.
Pri uporabi vode za gašenje požarov je treba upoštevati tudi nevarnost eksplozije pare, ki se lahko zgodi v zelo vročih požarih v zaprtih prostorih, in eksplozije vodika. Vodik nastaja v stiku vode z nekaterimi kovinami in žarečim ogljikom (premog, koks, oglje), pri čemer nastaja vodni plin.
Silovitost takšnih eksplozij je bila vidna v černobilski katastrofi. Vode v tem primeru ni prispevalo gašenje požara, temveč lastni hladilni sistem reaktorja. Do eksplozije pare je prišlo, ko je ekstremno pregreto jedro reaktorja povzročilo pretvorbo vode v paro. Eksplozija vodika bi lahko bila tudi posledica reakcije pare z vročim cirkonijem.
Nekateri kovinski oksidi, predvsem oksidi alkalijskih in zemeljskoalkalijskih kovin, pri reakciji z vodo proizvedejo dovolj toplote, da lahko povzroči požar. Živo apno (CaO) je množično proizvajana snov, ki se pogosto prevaža v papirnatih vrečah. Če se vreče zmočijo, se lahko vnamejo, saj njihova vsebina burno reagira z vodo in sprošča toploto.[119]
Šport in razvedrilo
[uredi | uredi kodo]Voda je priljubljen medij za različne športe in razvedrilo. Med najbolj množične vodne športe spadajo plavanje, smučanje na vodi, jadranje, surfanje in potapljanje. Na ledu in snegu se drsa, smuča in sanka. Šumenje tekoče vode pomirja, ribniki in vodometi pa krasijo naše okolje. Pomembno je tudi športno ribištvo.
Obdelava vode
[uredi | uredi kodo]V obdelavo vode spadajo priprava pitne in tehnološke vode in čiščenje komunalnih in industrijskih odplak.
Oskrba ljudi s pitno vodo vključuje vodna zajetja, vodnjake, cisterne za zbiranje deževnice, naprave za čiščenje vode, rezervoarje in vodovodno omrežje, vključno s starimi akvadukti. V razvoju so generatorji atmosferske vode.
Viri pitne vode so običajno izviri in vrtine (vodnjaki) ter jezera in vodotoki. Črpališča podtalnice bi morala biti na takšnih mestih, kjer podtalnico stalno obnavljajo površinski vodni viri. Med pomembne vodne vire spada tudi zbiranje deževnice. Voda za pitje zahteva ustrezno čiščenje, ki zajema odstranjevanje škodljivih raztopljenih snovi in mikroorganizmov. Priljubljena metoda je filtriranje s peščenimi filtri, ki odstranijo samo lebdeče delce. Škodljive mikroorganizme se uniči s prekuhavanjem in kloriranjem. Lebdeče delce, mikroorganizme in raztopljene snovi se odstrani z destilacijo. Sodobnejša metoda čiščenja je reverzna ozmoza. Pogosto je tudi razsoljevanje morske vode, ki je dražje in se uporablja zlasti na obalah s sušnim podnebjem.
Distribucija pitne vode poteka preko komunalnih vodovodnih sistemov, dostave s cisternami in ustekleničene vode. V mnogih državah je pitna voda brezplačna. V nekaterih državah, na primer v Hong Kongu, se pitna voda uporablja samo za nujne človeške potrebe, medtem ko se za sanitarije uporablja morska voda.
Onesnaževanje vode je lahko največja posamezna zloraba vode. Če onesnaževalo omejuje druge rabe vode, postane uničevalec vodnega vira, ne glede na koristi, ki jih ima onesnaževalec. Ceno onesnažene vode plačajo vsi, medtem ko se dobiček podjetij ne prerazporeja med lokalno prebivalstvo, ki je žrtev tega onesnaženja.
Farmacevtski izdelki, ki jih uživajo ljudje, pogosto končajo v vodotokih. Če niso biološko razgradljivi in se kopičijo v vodnih organizmih, imajo lahko škodljive učinke na vodno življenje. V razvitejšem delu sveta se komunalne in industrijske odpadne vode običajno čistijo v čistilnih napravah.
Raba v industriji
[uredi | uredi kodo]Veliko industrijskih postopkov temelji na kemičnih reakcijah v vodnih raztopinah, emulzijah in suspenzijah reaktantov in produktov. Voda se uporablja tudi za raztapljanje in ekstrakcijo snovi, izpiranje produktov in pranje procesne opreme. Veliko vode se porabi v rudarstvu, industriji celuloze in papirja, za beljenje, barvanje in tiskanje tekstila ter hlajenje. Industrija pogosto povzroča veliko onesnaženje vodni teles.


Energija vode se izkorišča tudi za proizvodnjo električne energije. Voda žene vodne turbine, povezane z generatorji. Tovrstna električna energija je poceni, obnovljiva in ne onesnažuje okolja.
Voda pod tlakom se uporablja za vodno peskanje in rezanje z vodnim curkom. Za natančno rezanje se uporabljajo visokotlačne vodne pištole. Postopek je zelo učinkovit, relativno varen in neškodljiv za okolje. Voda se uporablja tudi za hlajenje strojev in preprečevanje pregrevanja, na primer žaginih listov.
V številnih industrijskih procesih se uporablja kot topilo in medij za izmenjavo toplote. Voda za te namene mora biti ustrezno čista. Odvajanje neprečiščene industrijske vode v okolje je onesnaževanje, ki je lahko kemično, na primer izpust raztopin, in toplotno, na primer izpust vroče hladilne vode. Voda pred izpustom v okolje bi morala biti ustrezno očiščena in ohlajena.
Kemična industrija
[uredi | uredi kodo]Voda se v kemičnih reakcijah pogosto uporablja kot topilo ali reaktant in manj pogosto kot topljenec ali katalizator. V anorganskih reakcijah je voda običajno topilo, ki raztopi številne ionske in druge polarne spojine, kot so amonijak in spojine, podobne vodi. V organskih reakcijah se običajno ne uporablja kot topilo, ker slabo raztopi reaktante. Voda je amfoterna (kisla in bazična) in nukleofilna. Te lastnosti so včasih kljub temu zaželene.
V zadnjem času je predmet raziskav superkritična voda, ker nasičena s kisikom učinkovito oksidira organska onesnaževala. V nekaterih procesih v kemični industriji se uporablja tudi vodna para, na primer v proizvodnji akrilne kisline iz akroleina, propena in propana.[120][121][122][123] Možen učinek vode v teh reakcijah vključuje fizikalno in kemično interakcijo vode s katalizatorjem in kemično reakcijo vode z reakcijskimi vmesnimi produkti.
Priprava hrane
[uredi | uredi kodo]
Kuhanje v vodi in vodni pari sta priljubljena načina priprave hrane.[124] Voda se uporablja tudi za pomivanje posode in igra pomembno vlogo na področju znanosti o hrani.
Vodotopne snovi, kot so soli in sladkorji, vplivajo na fizikalne lastnosti vode. Raztopine imajo višje vrelišče in nižje tališče od vode. Predvsem na vrelišče vpliva tudi zračni tlak, ki je odvisen v glavnem od nadmorske višine. Voda pri nižjem zračnem tlaku vre pri nižji temperaturi. En mol saharoze (342,3 g) na kilogram vode zviša vrelišče za 0,51 °C, en mol soli (58,44 g) pa za 1,02 °C. Podobno se obnaša tudi ledišče, samo da z naraščanjem koncentracije topljenca pada.[125]
V vodi raztopljene snovi vplivajo tudi na aktivnost vode, ta pa na številne kemične reakcije in rast mikrobov.[126] Aktivnost vode se lahko opiše kot razmerje med parnim tlakom vode v raztopini in parnim tlakom čiste vode.[125] Aktivnost vode se v raztopinah zniža. Podatek je pomemben, ker se razvoj večine bakterij pri nizkih ravneh aktivnosti vode ustavi.[126] Rast mikrobov ne vpliva samo na varnost hrane, temveč tudi na njeno trajnost in rok uporabnosti.
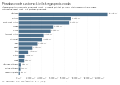
Kritičen dejavnik pri predelavi hrane je tudi trdota vode. Trdoto je mogoče zmanjšati s kemično obdelavo vode in ionsko izmenjavo, kar lahko dramatično vpliva na kakovost proizvoda in igra pomembno vlogo pri sanitarnih pogojih. Trdota vode se izraža z ekvivalentno vsebnostjo kalcijevega karbonata. Voda se šteje za mehko, če vsebuje manj kot 100 mg/l kalcijevega karbonata (Združeno kraljestvo)[127] ali manj kot 60 mg/l (ZDA).[128]
Poročilo, ki ga je leta 2010 objavila organizacija Water Footprint, pravi, da je za prirejo enega kilograma govejega mesa potrebno 15 tisoč litrov vode. Poročilo hkrati dodaja, da gre za globalno povprečje in da količino vode določajo posredni dejavniki pri proizvodnji govejega mesa.[129]
Raba v zdravstvu
[uredi | uredi kodo]V zdravstvu se voda uporablja za pripravo različnih raztopin, emulzij in suspenzij.[130]
Voda v naravi
[uredi | uredi kodo]Vesolje
[uredi | uredi kodo]
Velik del vode v vesolju nastaja kot stranski produkt nastajanja zvezd, ki ga spremlja močan veter plina in prahu. Ko veter naleti na okoliški plin, ga udarni valovi stisnejo in s tem segrejejo in ustvarijo pogoje za nastanek vode.[132]
Poročilo iz leta 2011 opisuje odkritje ogromnega oblaka vodne pare okoli kvazarja, oddaljenega 12 milijard svetlobnih let. Oblak vsebuje "140 trillijon krat več vode kot vsi oceani na Zemlji". Raziskovalci domnevajo, da voda v vesolju obstaja skoraj od začetka njegovega nastanka.[133][134]
Vodo so zaznali tudi v medzvezdnih oblakih v naši galaksiji Rimska cesta.[135] Obilje vode je verjetno tudi v drugih galaksijah, ker sta njeni komponenti vodik in kisik med najpogostejšima elementoma v vesolju. Modeli nastanka in razvoja Osončja in drugih zvezdnih sistemov kažejo, da ima podobno sestavo verjetno tudi večina drugih planetarnih sistemov
Vodna para
[uredi | uredi kodo]Voda kot vodna para je prisotna v
- atmosfera Sonca: zaznavni sledovi[136]
- atmosfera Merkurja: 3,4% in velike količine vode v Merkurjevi eksosferi[137]
- atmosfera Venere: 0,002%[138]
- atmosfera Zemlje: ≈0,40% (celotna atmosfera), na površini 1–4%; sledovi vode so tudi na Luni[139]
- atmosfera Marsa: 0,03%[140]
- atmosfera Cerere[141]
- atmosfera Saturna: samo led; Enkelad 91%,[142] Evropa[143] in Diona (eksosfera)
- atmosfera Urana: sledovi pod 50 bar
- atmosfera Neptuna: v globljih plasteh[144]
- atmosfere zunajsončnih planetov: vključno s HD 189733 b[145] in HD 209458 b,[146] Tau Boötis b,[147] HAT-P-11b,[148][149] XO-1b, WASP-12b, WASP-17b in WASP-19b[150]
- atmosfere zvezd: voda ni omejena na hladne zvezde, ampak je bila odkrita celo na gigantskih vročih zvezdah, kot so Betelgeza, Mi Cefeja, Antares in Arktur[151][152]
- cirkumstelarni diski: v več kot polovici diskov zvezd T Tauri, kot je AA Tauri,[153] TW Hidre,[154] IRC +10216,[155] in APM 08279+5255[133][134] VY Velikega psa in S Perzeja[149]
Tekoča voda
[uredi | uredi kodo]Tekoča voda na Zemlji pokriva 71 % njene površine.[17] V tekoči obliki je v majhnih količinah občasno prisotna tudi na Marsu.[156] Znanstveniki so prepričani, da je prisotna tudi na Saturnovi luni Enkelad kot 10 km globok ocean 30–40 km pod površino Enkeladovega južnega pola[157][158] in v sloju pod površino lune Titan, kjer je morda pomešana z amonijakom.[159] Površina Jupitrove lune Evropa kaže, da je pod njo ocean tekoče vode.[160] Tekoča voda bi lahko bila tudi na Jupitrovi luni Ganimed v slojih pod visokim tlakom med ledom in kamnino.[161]
Vodni led
[uredi | uredi kodo]
Voda kot led je prisotna na:
- Mars: pod regolitom in na polih[162][163]
- sistem Zemlja-Luna: ledene plošče na Zemlji in luninih kraterjih in vulkanskih kamninah.[164] NASA je poročala, da je njen instrument Moon Mineralogy Mapper na krovu vesoljskega plovila Chandrayaan-1 Indijske organizacije za vesoljske raziskave septembra 2009 na Luni odkril molekule vode.[165]
- Cerera[166][167][168]
- Jupitrove lune: površina Evrope, Ganimed[169] in Kalisto[170][171]
- Saturn: v obročih planeta[172] in na površini in plašču Titana[173] in Enkelada[174]
- sistem Pluton-Haron[172]
- kometi[175][176] in druga telesa, povezana s Kuiperjevim pasom in Oortovim oblakom[177]
Led je zelo verjetno tudi na
Eksotične oblike
[uredi | uredi kodo]Voda in druge hlapne snovi verjetno sestavljajo večino notranjosti Urana in Neptuna. Voda v globokih plasteh je lahko v obliki ionske vode, v kateri so molekule razgrajene v juho vodikovih in kisikovih ionov, in še globlje v obliki superionske vode, v kateri kisik kristalizira, vodikovi ioni pa se prosto gibljejo znotraj kisikove kristalne rešetke.[180]
Voda in naseljivost planetov
[uredi | uredi kodo]Obstoj tekoče vode in v manjši meri njenih plinastih in trdnih oblik na Zemlji je ključnega pomena za obstoj življenja na Zemlji. Zemlja se nahaja v tako imenovanem bivalnem območju Osončja: če bi bila nekoliko bliže ali dlje od Sonca (približno 5 % ali približno 8 milijonov kilometrov), bi bilo veliko manj verjetno, da bi obstajala v vseh treh agragatnih stanjh hkrati.[181][182] Vodna para in ogljikov dioksid v ozračju zagotavljata temperaturni pufer (učinek tople grede), ki pomaga vzdrževati razmeroma stabilno temperaturo njene površine. Če bi bila Zemlja manjša, bi tanjša atmosfera dopuščala temperaturne ekstreme, ki bi onemogočali kopičenje vode, razen v polarnih ledenih pokrovih, tako kot na Marsu.
Temperatura površine Zemlje je bila relativno konstantna skozi njeno geološko zgodovino, kljub različnim ravnem dohodnega sončnega sevanja, kar kaže, da temperaturo Zemlje uravnava dinamičen proces kombinacije toplogrednih plinov in površinskega in atmosferskega albeda. Ta domneva je znana kot Gajina hipoteza.[183]
Stanje vode na nekem planetu je odvisno od tlaka, ki ga ustvarja njegova gravitacija. Če je planet dovolj masiven, je voda zaradi visokega tlaka lahko trdna tudi pri visokih temperaturah. To so opazili tudi na eksoplanetih Gliese 436 b in GJ 1214 b.[184]
Zakonodaja in politika
[uredi | uredi kodo]Voda je strateška dobrina in zato pomemben element v številnih političnih konfliktih skozi človeško zgodovino, zaradi česar je že dolgo tudi predmet pravnega urejanja. Mednarodno pravo se je sprva ukvarjalo s plovbo, v sodobnosti pa je prišel v ospredje tudi problem pitne vode kot človekove pravice in Konvencija o odpravi vseh oblik diskriminacije žensk (1979) je bil prvi zavezujoč mednarodni dokument, ki je pitno vodo izrecno omenjal. Kot temeljno človekovo potrebo je pravico do varne pitne vode sicer možno izpeljati tudi iz starejših dokumentov o človekovih pravicah od Splošne deklaracije človekovih pravic dalje.[185] Slovenija je med redkimi državami, ki imajo pravico do pitne vode zapisano v ustavo ali enakovreden pravni akt, pri čemer pa vsaj v Sloveniji izvajanje tega akta ob sprejetju leta 2016 ni bilo natančneje opredeljeno.[186]
Dostop do varne pitne vode se je v zadnjih desetletjih izboljšal v skoraj vseh delih sveta, vendar približno milijarda ljudi še vedno nima dostopa do varne vode. Več kot 2,5 milijarde ljudi nima dostopa do ustreznih sanitarij.[187] Nekateri opazovalci ocenjujejo, da se bo do leta 2025 več kot polovica svetovnega prebivalstva soočala z ranljivostjo zaradi vode.[188] Poročilo, objavljeno novembra 2009, kaže, da bo do leta 2030 v nekaterih regijah sveta v razvoju povpraševanje po vodi za 50 % preseglo ponudbo.[187]
Od leta 1990 do 2010 je dostop do pitne vode dobilo 1,6 milijarde ljudi.[189] Delež prebivalcev v državah v razvoju, ki imajo dostop do pitne vode, se je od 30 % leta 1970[190] povečal na 71 % leta 1990, 79 % leta 2000 in 84 % leta 2004.
Poročilo Združenih narodov iz leta 2006 navaja, da je »vode dovolj za vse, vendar dostop do nje ovirata slabo upravljanje in korupcija«.[191]
Voda v kulturi
[uredi | uredi kodo]Religija
[uredi | uredi kodo]
Voda v večini verstev velja za čistilo. Med religije, ki vključujejo obredno umivanje, spadajo krščanstvo,[192] hinduizem, islam, judovstvo, rastafarijanstvo, šintoizem, taoizem in vika. Potapljanje, polivanje ali škropljenje osebe z vodo je osrednji zakrament krščanstva, ki se imenuje krst. Vse to je tudi del prakse drugih religij, vključno z islamom (gusul), judovstvom (mikve) in sikizmom (amrit sanskar). Obredno kopanje v čisti vodi se v številnih verstvih opravlja tudi za mrtve. Mednje spadajo islam in judovstvo. V islamu je pet obveznih dnevnih molitev v večini primerov mogoče opraviti samo po umivanju določenih delov telesa s čisto vodo (vudu), razen če voda ni na voljo (tadžammum). V šintoizmu se voda uporablja v skoraj vseh obredih za čiščenje osebe ali prostora, na primer v obredu misogi.
V krščanstvu je sveta voda voda, ki jo je posvetil duhovnik za krst, blagoslovitev osebe, prostora ali predmeta in odvračanje zla.[193][194]
V zaratustrstvu se voda šteje za vir življenja.[195]
Filozofija
[uredi | uredi kodo]
Starogrški filozof Empedoklej je videl vodo kot enega od štirih klasičnih elementov. Drugi trije so bili ogenj, zemlja in zrak. Imel jo je za ilem ali osnovno snov vesolja. Tales, ki ga je Aristotel opisal kot astronoma in inženirja, je teoretiziral, da je zemlja, ki je gostejša od vode, nastala iz vode. Tales, monist, je nadalje verjel, da so vse stvari narejene iz vode. Platon je verjel, da ima voda obliko ikozaedra, s čimer je razložil, zakaj zlahka teče v primerjavi z zemljo, ki ji je pripisal bliko kocke.[196]
Teorija o štirih telesnih sokovih je vodo povezovala s sluzjo kot njeno hladno in vlažno lastnost. Klasični element voda je bil tudi eden od petih elementov v tradicionalni kitajski filozofiji, skupaj z zemljo, ognjem, lesom in kovino.
Nekateri tradicionalni in priljubljeni azijski filozofski sistemi jemljejo vodo za vzornika. Prevod Dao De Jinga Jamesa Leggea iz leta 1891 pravi:
- "Najvišja odličnost je (kot) voda. Njena odličnost se kaže v tem, da koristi vsem stvarem, in v tem, da zaseda, ne da bi si prizadevala, ravno nasprotno, nizko mesto, ki ga vsi ljudje ne marajo. Zato je (njena pot) blizu Taa (Taove poti). Nič na svetu ni bolj mehkega in šibkejšega od vode, in vendar za napad na stvari, ki so trdne in močne, ni ničesar, kar bi lahko imelo prednost pred njo – saj ni ničesar (tako učinkovitega), s čimer bi jo bilo mogoče zamenjati."[197]
Guanzi v poglavju "Šui di" (水地) podrobno razpravlja o simboliki vode in razglaša, da je "človek voda", in pripisuje naravne lastnosti ljudi različnih kitajskih regij lastnostim lokalnih vodnih virov.[198]
Ljudska kultura
[uredi | uredi kodo]Živa voda je v germanskih in slovanskih pravljicah sredstvo za oživljanje mrtvih. Med najbolj znane tovrstne pripovedi spadajo Grimmova "Voda življenja" in ruska delitev na živo in mrtvo vodo. Soroden koncept čarobnih voda predstavlja voda iz vodnjaka mladosti, ki naj bi preprečila staranje.
Umetnost in aktivizem
[uredi | uredi kodo]Slikarka in vodna aktivistka Fredericka Foster je v stolnici sv. Janeza Božanskega v New Yorku[199] organizirala razstavo z naslovom Dragocenost vode, ki je eno leto promovirala idejo o naši odvisnosti od vode.[200][201] Razstava je bila največja, ki je bila kdaj na ogled v stolnici.[202] Na razstavi je sodelovalo več kot štirideset slikarjev, med njimi Jenny Holzer, Robert Longo, Mark Rothko, William Kentridge, April Gornik, Kiki Smith, Pat Steir, William Kentridge, Alice Dalton Brown, Teresita Fernandez in Bill Viola.[203][204] Fosterjeva je ustanovila skupino umetnikov z imenom Razmišljanje o vodi, ki uporabljajo vodo kot predmet ali medij. Med člani skupine so tudi Basia Irland, Aviva Rahmani, Betsy Damon, Diane Burko, Leila Daw, Stacy Levy, Charlotte Coté,[205] Meridel Rubenstein, Stacy Levy, Anna Macleod in Aviva Rahmani.
Ob 10. obletnici razglasitve Organizacije združenih narodov, da je dostop do vode in sanitarij temeljna človekova pravica, je dobrodelna organizacija Water Aid naročila desetim vizualnim umetnikom, da prikažejo vpliv čiste vode na življenja ljudi.[206][207]
Potegavščine z divodikovim monoksidom
[uredi | uredi kodo]Divodikov monoksid je tehnično pravilno, vendar redko uporabljeno kemično ime vode. Ime je bilo uporabljeno v številnih potegavščinah in šalah na račun znanstvene nepismenosti. Potegavščine so se začele leta 1983, ko se je v časopisu v Durandu v Michiganu pojavil prvoaprilski članek o tem monoksidu. Lažna zgodba je vključevala resne varnostne pomisleke glede te spojine.[208] S kasnejšimi predelavami in različicami je dobila širšo prepoznavnost.[209]
Opombe
[uredi | uredi kodo]- ↑ 1,0 1,1 Vzorec Vienna Standard Mean Ocean Water (VSMOW) za kalibracije se topi pri 273,1500089(10) K (0,000089(10) °C in vre pri 373,1339 K (99,9839 °C). Druge izotopske sestave se topijo ali vrejo pri rahlo drugačnih temperaturah.
- ↑ Predvsem v organski kemiji pogosto navajana vrednost 15,7 za pKa vode je nepravilna.[8][9]
Sklici
[uredi | uredi kodo]- ↑ John Riddick (1970). Organic Solvents Physical Properties and Methods of Purification. Wiley-Interscience. str. 67-68. ISBN 978-0471927266.
- ↑ Hannu Sipola, Pekka Taskinen (julij 2018). "Activity of Supercooled Water on the Ice Curve and Other Thermodynamic Properties of Liquid Water up to the Boiling Point at Standard Pressure". Journal of Chemical & Engineering Data 63 (8). DOI: 10.1021/acs.jced.8b00251. Pridobljeno 20. aprila 2022.
- ↑ Water in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD), http://webbook.nist.gov (pridobljeno 2016-5-27)
- ↑ 4,0 4,1 4,2 Anatolievich, Kiper Ruslan. »Properties of substance: water«. Arhivirano iz prvotnega spletišča dne 2. junija 2014. Pridobljeno 18. aprila 2022.
- ↑ David R. Lide (ur.). CRC Handbook of Chemistry and Physics. 85. izdaja. Internet-Version: 2005. CRC Press/Taylor and Francis. Boca Raton, FL. Fluid Properties, str. 6-3 – 6-5.
- ↑ Lide 2003, Chapter 8: Dissociation Constants of Inorganic Acids and Bases.
- ↑ Weingärtner, Hermann; Franck, Ernst Ulrich (25. april 2005). »Supercritical Water as a Solvent«. Angewandte Chemie International Edition. Zv. 44, št. 18. str. 2672–2692. doi:10.1002/anie.200462468. ISSN 1433-7851.
- ↑ »What is the pKa of Water«. Univerza Kalifornije, Davis. 9. avgust 2015. Arhivirano iz prvotnega spletišča dne 14. februarja 2016. Pridobljeno 18. aprila 2022.
- ↑ Silverstein, Todd P.; Heller, Stephen T. (17. april 2017). »pKa Values in the Undergraduate Curriculum: What Is the Real pKa of Water?«. Journal of Chemical Education. Zv. 94, št. 6. str. 690–695. Bibcode:2017JChEd..94..690S. doi:10.1021/acs.jchemed.6b00623.
- ↑ Ramires, Maria L. V.; Castro, Carlos A. Nieto de; Nagasaka, Yuchi; Nagashima, Akira; Assael, Marc J.; Wakeham, William A. (1. maj 1995). »Standard Reference Data for the Thermal Conductivity of Water«. Journal of Physical and Chemical Reference Data. Zv. 24, št. 3. str. 1377–1381. Bibcode:1995JPCRD..24.1377R. doi:10.1063/1.555963. ISSN 0047-2689.
- ↑ Lide 2003, 8—Concentrative Properties of Aqueous Solutions: Density, Refractive Index, Freezing Point Depression, and Viscosity.
- ↑ Lide 2003, 6.186.
- ↑ Lide 2003, 9—Dipole Moments.
- ↑ 14,0 14,1 14,2 Water in Linstrom, Peter J.; Mallard, William G. (eds.); NIST Chemistry WebBook, NIST Standard Reference Database Number 69, National Institute of Standards and Technology, Gaithersburg (MD), http://webbook.nist.gov (pridobljeno 2014-06-01)
- ↑ »Water Q&A: Why is water the »universal solvent«?«. United States Geological Survey. Pridobljeno 15. januarja 2021.
- ↑ »10.2: Hybrid Orbitals in Water«. Chemistry LibreTexts (v angleščini). 18. marec 2020. Pridobljeno 11. aprila 2021.
- ↑ 17,0 17,1 »CIA – THE WORLD FACTBOOK Geography Geographic overview«. Centralna obveščevalna agencija. Pridobljeno 20. decembra 2008.
- ↑ 18,0 18,1 Gleick, P.H., ur. (1993). Water in Crisis: A Guide to the World's Freshwater Resources. Oxford University Press. str. 13. Arhivirano iz prvotnega spletišča dne 8. aprila 2013.
- ↑ Water Vapor in the Climate System : Special report. Ameriško geofizikalno združenje. december 1995. Arhivirano iz prvotnega spletišča dne 2007-03-28. https://web.archive.org/web/20070320034158/http://www.agu.org/sci_soc/mockler.html.
- ↑ »Vital Water«. UNEP. Arhivirano iz prvotnega spletišča dne 20. februarja 2008.
- ↑ Baroni, L.; Cenci, L.; Tettamanti, M.; Berati, M. (2007). »Evaluating the environmental impact of various dietary patterns combined with different food production systems«. European Journal of Clinical Nutrition. Zv. 61, št. 2. str. 279–286. doi:10.1038/sj.ejcn.1602522. PMID 17035955.
- ↑ »Water (v.)«. www.etymonline.com. Online Etymology Dictionary. Arhivirano iz spletišča dne 2. avgusta 2017. Pridobljeno 20. maja 2017.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. izd.). Butterworth-Heinemann. str. 620. ISBN 978-0-08-037941-8.
- ↑ »Water, the Universal Solvent«. USGS. Arhivirano iz spletišča dne 9. julija 2017. Pridobljeno 27. junija 2017.
- ↑ Reece 2013, str. 48.
- ↑ Reece 2013, str. 44.
- ↑ Leigh, G. J.; Favre, H. A; Metanomski, W. V. (1998). Principles of chemical nomenclature: a guide to IUPAC recommendations (PDF). Oxford: Blackwell Science. ISBN 978-0-86542-685-6. OCLC 37341352. Arhivirano iz prvotnega spletišča (PDF) dne 26. julija 2011.
- ↑ PubChem. »Water« (v angleščini). National Center for Biotechnology Information. Pridobljeno 25. marca 2020.
- ↑ 29,0 29,1 Belnay, Louise. »The water cycle« (PDF). Critical thinking activities. Earth System Research Laboratory. Pridobljeno 25. marca 2020.
- ↑ 30,0 30,1 Oliveira, Mário J. de (2017). Equilibrium Thermodynamics (v angleščini). Springer. str. 120–124. ISBN 978-3-662-53207-2. Pridobljeno 26. marca 2020.
- ↑ 31,0 31,1 Ball, Philip (2008). »Water: Water—an enduring mystery«. Nature. Zv. 452, št. 7185. str. 291–2. Bibcode:2008Natur.452..291B. doi:10.1038/452291a. PMID 18354466. S2CID 4365814. Arhivirano iz spletišča dne 17. novembra 2016. Pridobljeno 15. novembra 2016.
- ↑ Kotz, J.C.; Treichel, P.; Weaver, G.C. (2005). Chemistry & Chemical Reactivity. Thomson Brooks/Cole. ISBN 978-0-534-39597-1.
- ↑ Ben-Naim, Ariel; Ben-Naim, Roberta; in sod. (2011). Alice's Adventures in Water-land. Singapore. doi:10.1142/8068. ISBN 978-981-4338-96-7.
- ↑ Matsuoka, N.; Murton, J. (2008). »Frost weathering: recent advances and future directions«. Permafrost Periglac. Process. Zv. 19, št. 2. str. 195–210. doi:10.1002/ppp.620.
- ↑ Wiltse, Brendan. »A Look Under The Ice: Winter Lake Ecology«. Ausable River Association. Pridobljeno 23. aprila 2020.
- ↑ 36,0 36,1 Chen, Zijun (21. april 2010). »Measurement of Diamagnetism in Water« (v ameriški angleščini).
{{navedi revijo}}: Sklic magazine potrebuje|magazine=(pomoč) - ↑ Wells, Sarah (21. januar 2017). »The Beauty and Science of Snowflakes«. Smithsonian Science Education Center (v angleščini). Pridobljeno 25. marca 2020.
- ↑ Fellows, P. (Peter) (2017). »Freeze drying and freeze concentration«. Food processing technology: principles and practice (4th izd.). Kent: Woodhead Publishing/Elsevier Science. str. 929–940. ISBN 978-0081005231. OCLC 960758611.
- ↑ Siegert, Martin J.; Ellis-Evans, J. Cynan; Tranter, Martyn; Mayer, Christoph; Petit, Jean-Robert; Salamatin, Andrey; Priscu, John C. (december 2001). »Physical, chemical and biological processes in Lake Vostok and other Antarctic subglacial lakes«. Nature. Zv. 414, št. 6864. str. 603–609. Bibcode:2001Natur.414..603S. doi:10.1038/414603a. PMID 11740551. S2CID 4423510.
{{navedi revijo}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Davies, Bethan. »Antarctic subglacial lakes«. AntarcticGlaciers. Pridobljeno 25. marca 2020.
- ↑ Masterton, William L.; Hurley, Cecile N. (2008). Chemistry : principles and reactions (6th izd.). Cengage Learning. str. 230. ISBN 9780495126713. Pridobljeno 3. aprila 2020.
- ↑ Peaco, Jim. »Yellowstone Lesson Plan: How Yellowstone Geysers Erupt - Yellowstone National Park (U.S. National Park Service)«. National Park Service (v angleščini). Pridobljeno 5. aprila 2020.
- ↑ Brahic, Catherine. »Found: The hottest water on Earth«. New Scientist. Pridobljeno 5. aprila 2020.
- ↑ USDA Food Safety and Inspection Service. »High Altitude Cooking and Food Safety« (PDF). Arhivirano iz prvotnega spletišča (PDF) dne 20. januarja 2021. Pridobljeno 5. aprila 2020.
- ↑ »Pressure Cooking - Food Science«. Exploratorium (v angleščini). 26. september 2019.
- ↑ Allain, Rhett (12. september 2018). »Yes, You Can Boil Water at Room Temperature. Here's How«. Wired (v angleščini). Pridobljeno 5. aprila 2020.
- ↑ Murphy, D. M.; Koop, T. (1. april 2005). »Review of the vapour pressures of ice and supercooled water for atmospheric applications«. Quarterly Journal of the Royal Meteorological Society. Zv. 131, št. 608. str. 1540. Bibcode:2005QJRMS.131.1539M. doi:10.1256/qj.04.94.
- ↑ The International System of Units (SI) (PDF) (8. izd.), Mednarodni urad za uteži in mere, 2006, str. 114, ISBN 92-822-2213-6, arhivirano (PDF) iz spletišča dne 14. avgusta 2017
- ↑ »9th edition of the SI Brochure«. Mednarodni urad za uteži in mere. 2019. Pridobljeno 20. maja 2019.
- ↑ Wagner, W.; Pruß, A. (Junij 2002). »The IAPWS Formulation 1995 for the Thermodynamic Properties of Ordinary Water Substance for General and Scientific Use«. Journal of Physical and Chemical Reference Data. Zv. 31, št. 2. str. 398. doi:10.1063/1.1461829.
- ↑ Weingärtner, Hermann; Franck, Ernst Ulrich (29. april 2005). »Supercritical Water as a Solvent«. Angewandte Chemie International Edition. Zv. 44, št. 18. str. 2672–2692. doi:10.1002/anie.200462468. PMID 15827975.
- ↑ Adschiri, Tadafumi; Lee, Youn-Woo; Goto, Motonobu; Takami, Seiichi (2011). »Green materials synthesis with supercritical water«. Green Chemistry. Zv. 13, št. 6. str. 1380. doi:10.1039/c1gc15158d.
- ↑ Murray, Benjamin J.; Knopf, Daniel A.; Bertram, Allan K. (2005). »The formation of cubic ice under conditions relevant to Earth's atmosphere«. Nature. Zv. 434, št. 7030. str. 202–205. Bibcode:2005Natur.434..202M. doi:10.1038/nature03403. PMID 15758996. S2CID 4427815.
- ↑ Salzmann, Christoph G. (14. februar 2019). »Advances in the experimental exploration of water's phase diagram«. The Journal of Chemical Physics. Zv. 150, št. 6. str. 060901. arXiv:1812.04333. Bibcode:2019JChPh.150f0901S. doi:10.1063/1.5085163. PMID 30770019.
- ↑ Sokol, Joshua (12. maj 2019). »A Bizarre Form of Water May Exist All Over the Universe«. Wired. Wired.com. Arhivirano iz spletišča dne 12. maja 2019. Pridobljeno 1. septembra 2021.
- ↑ Millot, M.; Coppari, F.; Rygg, J.R.; Barrios, Antonio Correa; Hamel, Sebastien; Swift, Damian C.; Eggert, Jon H. (2019). »Nanosecond X-ray diffraction of shock-compressed superionic water ice«. Nature. Zv. 569, št. 7755. Springer. str. 251–255. Bibcode:2019Natur.569..251M. doi:10.1038/s41586-019-1114-6. OSTI 1568026. PMID 31068720. S2CID 148571419.
- ↑ Peplow, Mark (25. marec 2015). »Graphene sandwich makes new form of ice«. Nature. doi:10.1038/nature.2015.17175. S2CID 138877465.
- ↑ Maestro, L.M.; Marqués, M.I.; Camarillo, E.; Jaque, D.; Solé, J. García; Gonzalo, J.A.; Jaque, F.; Valle, Juan C. Del; Mallamace, F. (1. januar 2016). »On the existence of two states in liquid water: impact on biological and nanoscopic systems«. International Journal of Nanotechnology. Zv. 13, št. 8–9. str. 667–677. Bibcode:2016IJNT...13..667M. doi:10.1504/IJNT.2016.079670. Arhivirano iz spletišča dne 23. septembra 2017.
- ↑ Mallamace, Francesco; Corsaro, Carmelo; Stanley, H. Eugene (18. december 2012). »A singular thermodynamically consistent temperature at the origin of the anomalous behavior of liquid water«. Scientific Reports. Zv. 2, št. 1. str. 993. Bibcode:2012NatSR...2E.993M. doi:10.1038/srep00993. PMC 3524791. PMID 23251779.
- ↑ Perakis, Fivos; Amann-Winkel, Katrin; Lehmkühler, Felix; Sprung, Michael; Mariedahl, Daniel; Sellberg, Jonas A.; Pathak, Harshad; Späh, Alexander; Cavalca, Filippo; Ricci, Alessandro; Jain, Avni; Massani, Bernhard; Aubree, Flora; Benmore, Chris J.; Loerting, Thomas; Grübel, Gerhard; Pettersson, Lars G.M.; Nilsson, Anders (26. junij 2017). »Diffusive dynamics during the high-to-low density transition in amorphous ice«. Proceedings of the National Academy of Sciences of the United States of America. Zv. 13, št. 8–9. str. 667–677. Bibcode:2017PNAS..114.8193P. doi:10.1073/pnas.1705303114. PMC 5547632. PMID 28652327.
- ↑ Rolls, Edmund T. (2005). Emotion Explained. Oxford University Press, Medical. ISBN 9780198570035.
- ↑ Llinas, R.; Precht W. (2012). Frog Neurobiology: A Handbook. Springer Science & Business Media. ISBN 9783642663161.
- ↑ Candau, Joël (2004). »The Olfactory Experience: constants and cultural variables«. Water Science and Technology. Zv. 49, št. 9. str. 11–17. doi:10.2166/wst.2004.0522. PMID 15237601. Arhivirano iz spletišča dne 2. oktobra 2016. Pridobljeno 28. septembra 2016.
- ↑ Braun, Charles L.; Smirnov, Sergei N. (1993). »Why is water blue?«. J. Chem. Educ. Zv. 70, št. 8. str. 612. Bibcode:1993JChEd..70..612B. doi:10.1021/ed070p612. Arhivirano iz spletišča dne 20. marca 2012. Pridobljeno 21. aprila 2007.
- ↑ Nakamoto, Kazuo (1997). Infrared and Raman Spectra of Inorganic and Coordination Compounds, Part A: Theory and Applications in Inorganic Chemistry (5th ed.). New York: Wiley. str. 170. ISBN 0-471-16394-5.
- ↑ Ball 2001, str. 168.
- ↑ Franks 2007, str. 10.
- ↑ »Physical Chemistry of Water«. Michigan State University. Pridobljeno 11. septembra 2020.
- ↑ Ball 2001, str. 169.
- ↑ Isaacs, E.D; Shukla, A; Platzman, P.M; Hamann, D.R; Barbiellini, B; Tulk, C.A (1. marec 2000). »Compton scattering evidence for covalency of the hydrogen bond in ice«. Journal of Physics and Chemistry of Solids. Zv. 61, št. 3. str. 403–406. Bibcode:2000JPCS...61..403I. doi:10.1016/S0022-3697(99)00325-X.
- ↑ Campbell, Neil A.; Williamson, Brad; Heyden, Robin J. (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 978-0-13-250882-7. Arhivirano iz spletišča dne 2. novembra 2014. Pridobljeno 11. novembra 2008.
- ↑ Capillary Action – Liquid, Water, Force, and Surface – JRank Articles Arhivirano 27. maja 2013 na Wayback Machine.. Science.jrank.org. Pridobljeno 28. septembra 2015.
- ↑ Ball, Philip (14. september 2007). »Burning water and other myths«. News@nature. doi:10.1038/news070910-13. S2CID 129704116. Arhivirano iz spletišča dne 28. februarja 2009. Pridobljeno 14. septembra 2007.
- ↑ Fine, R.A.; Millero, F.J. (1973). »Compressibility of water as a function of temperature and pressure«. Journal of Chemical Physics. Zv. 59, št. 10. str. 5529. Bibcode:1973JChPh..59.5529F. doi:10.1063/1.1679903.
- ↑ UK National Physical Laboratory, Calculation of absorption of sound in seawater Arhivirano 3. oktobra 2016 na Wayback Machine..
- ↑ Gleick, P.H., ur. (1993). Water in Crisis: A Guide to the World's Freshwater Resources. Oxford University Press. str. 15, Table 2.3. Arhivirano iz prvotnega spletišča dne 8. aprila 2013.
- ↑ Ben-Naim, Arieh; Ben-Naim, Roberta (2011). Alice's Adventures in Water-land. World Scientific Publishing. str. 31. doi:10.1142/8068. ISBN 978-981-4338-96-7.
- ↑ Gleick, Peter H. (1993). Water in Crisis (1 izd.). New York: Oxford University Press. str. [1]. ISBN 019507627-3.
- ↑ Wada, Yoshihide; Van Beek, L.P.H.; Bierkens, Marc FP (2012). »Nonsustainable groundwater sustaining irrigation: A global assessment«. Water Resources Research. Zv. 48, št. 6. str. W00L06. Bibcode:2012WRR....48.0L06W. doi:10.1029/2011WR010562.
- ↑ »Catalyst helps split water : Plants«. AskNature (v ameriški angleščini). Pridobljeno 10. septembra 2020.
- ↑ »On Water«. Evropska investicijska banka (v angleščini). Pridobljeno 13. oktobra 2020.
- ↑ »2.4 billion Without Adequate Sanitation. 600 million Without Safe Water. Can We Fix it by 2030?«. ieg.worldbankgroup.org (v angleščini). Pridobljeno 13. oktobra 2020.
- ↑ »World Health Organization. Safe Water and Global Health«. Who.int. 25. junij 2008. Arhivirano iz spletišča dne 24. decembra 2010. Pridobljeno 25. julija 2010.
- ↑ UNEP International Environment (2002). Environmentally Sound Technology for Wastewater and Stormwater Management: An International Source Book. IWA Publishing. ISBN 978-1-84339-008-4. OCLC 49204666.
- ↑ Ravindranath, Nijavalli H.; Sathaye, Jayant A. (2002). Climate Change and Developing Countries. Springer. ISBN 978-1-4020-0104-8. OCLC 231965991.
- ↑ »Kemijsko stanje površinskih voda v Sloveniji-Poročilo za leto 2020« (PDF). Agencija RS za okolje (ARSO). november 2021.
{{navedi splet}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ »Ekološko stanje površinskih voda v Sloveniji-Poročilo o monitoringu za leto 2018« (PDF). ARSO. Oktober 2020. Pridobljeno 7. junija 2022.
- ↑ »Water withdrawals per capita«. Our World in Data. Pridobljeno 6. marca 2020.
- ↑ »WBCSD Water Facts & Trends«. Arhivirano iz prvotnega spletišča dne 1. marca 2012. Pridobljeno 25. julija 2010.
- ↑ United Nations Press Release POP/952 (13. marec 2007). World population will increase by 2.5 billion by 2050 Arhivirano 27. julija 2014 na Wayback Machine.
- ↑ Molden, D. (ur). Water for food, Water for life: A Comprehensive Assessment of Water Management in Agriculture. Earthscan/IWMI, 2007.
- ↑ Chartres, C., Varma, S. (2010). Out of water. From Abundance to Scarcity and How to Solve the World's Water Problems. FT Press (US).
- ↑ Chapagain, A.K.; Hoekstra, A.Y.; Savenije, H.H.G.; Guatam, R. (september 2005). »The Water Footprint of Cotton Consumption« (PDF). IHE Delft Institute for Water Education. Arhivirano (PDF) iz spletišča dne 26. marca 2019. Pridobljeno 24. oktobra 2019.
{{navedi splet}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Décret relatif aux poids et aux mesures. 18 germinal an 3 (7. april 1795) Arhivirano 25. februarja 2013 na Wayback Machine. (francosko). quartier-rural.org
- ↑ here L'Histoire Du Mètre, La Détermination De L'Unité De Poids Arhivirano 25. julija 2013 na Wayback Machine.. histoire.du.metre.free.fr
- ↑ Re: What percentage of the human body is composed of water? Arhivirano 25. novembra 2007 na Wayback Machine. Jeffrey Utz, M.D., The MadSci Network
- ↑ »Healthy Water Living«. BBC. Arhivirano iz prvotnega spletišča dne 1. januarja 2007. Pridobljeno 1. februarja 2007.
- ↑ Rhoades RA; Tanner GA (2003). Medical Physiology (2. izd.). Baltimore: Lippincott Williams & Wilkins. ISBN 978-0-7817-1936-0. OCLC 50554808.
- ↑ Noakes TD; Goodwin N; Rayner BL; in sod. (1985). »Water intoxication: a possible complication during endurance exercise«. Med Sci Sports Exerc. Zv. 17, št. 3. str. 370–375. doi:10.1249/00005768-198506000-00012. PMID 4021781.
- ↑ Noakes TD; Goodwin N; Rayner BL; Branken T; Taylor RK (2005). »Water intoxication: a possible complication during endurance exercise, 1985«. Wilderness Environ Med. Zv. 16, št. 4. str. 221–227. doi:10.1580/1080-6032(2005)16[221:WIAPCD]2.0.CO;2. PMID 16366205.
- ↑ Valtin, Heinz (2002). »"Drink at least eight glasses of water a day." Really? Is there scientific evidence for "8 × 8"?« (PDF). American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. Zv. 283, št. 5. str. R993–R1004. doi:10.1152/ajpregu.00365.2002. PMID 12376390. S2CID 2256436. Arhivirano iz prvotnega spletišča (PDF) dne 22. februarja 2019.
- ↑ Stookey JD; Constant F; Popkin BM; Gardner CD (november 2008). »Drinking water is associated with weight loss in overweight dieting women independent of diet and activity«. Obesity. Zv. 16, št. 11. str. 2481–2488. doi:10.1038/oby.2008.409. PMID 18787524. S2CID 24899383.
{{navedi revijo}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ »Drink water to curb weight gain? Clinical trial confirms effectiveness of simple appetite control method«. www.sciencedaily.com. 23. avgust 2010. Arhivirano iz spletišča dne 7. julija 2017. Pridobljeno 14. maja 2017.
- ↑ Dubnov-Raz G; Constantini NW; Yariv H; Nice S; Shapira N (Oktober 2011). »Influence of water drinking on resting energy expenditure in overweight children«. International Journal of Obesity. Zv. 35, št. 10. str. 1295–1300. doi:10.1038/ijo.2011.130. PMID 21750519.
- ↑ Dennis EA; Dengo AL; Comber DL; in sod. (Februar 2010). »Water consumption increases weight loss during a hypocaloric diet intervention in middle-aged and older adults«. Obesity. Zv. 18, št. 2. str. 300–307. doi:10.1038/oby.2009.235. PMC 2859815. PMID 19661958.
- ↑ Vij VA; Joshi AS (september 2013). »Effect of 'water induced thermogenesis' on body weight, body mass index and body composition of overweight subjects«. Journal of Clinical and Diagnostic Research. Zv. 7, št. 9. str. 1894–1896. doi:10.7860/JCDR/2013/5862.3344. PMC 3809630. PMID 24179891.
{{navedi revijo}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ Muckelbauer R; Sarganas G; Grüneis A; Müller-Nordhorn J (Avgust 2013). »Association between water consumption and body weight outcomes: a systematic review«. The American Journal of Clinical Nutrition. Zv. 98, št. 2. str. 282–299. doi:10.3945/ajcn.112.055061. PMID 23803882. S2CID 12265434.
- ↑ Water, Constipation, Dehydration, and Other Fluids Arhivirano 4. marec 2015 na Wayback Machine.. Sciencedaily.com. Pridobljeno 28. sptembra 2015.
- ↑ Food and Nutrition Board, National Academy of Sciences. Recommended Dietary Allowances. National Research Council, Reprint and Circular Series, No. 122. 1945. str. 3–18.
- ↑ Dietary Reference Intakes for Water, Potassium, Sodium, Chloride, and Sulfate. Washington, D.C.: National Academies Press. 18. maj 2005. doi:10.17226/10925. ISBN 978-0-309-09169-5.
- ↑ »Water: How much should you drink every day?«. Mayoclinic.com. Arhivirano iz spletišča dne 4. decembra 2010. Pridobljeno 25. julija 2010.
- ↑ Smith, Roland (2008). Conquering Chemistry (4. izd.). Cengage Learning Australia. ISBN 978-0170226820.
- ↑ Maton, Anthea; Jean Hopkins; Charles William McLaughlin; Susan Johnson; Maryanna Quon Warner; David LaHart; Jill D. Wright (1993). Human Biology and Health. Englewood Cliffs, New Jersey: Prentice Hall. ISBN 978-0-13-981176-0. OCLC 32308337.
- ↑ Unesco (2006). Water: a shared responsibility. Berghahn Books. str. 125. ISBN 978-1-84545-177-6.
- ↑ »Morphometric data«. A new bathymetric map of Lake Baikal. Gent: Univerza v Gentu. Oktober 2002. Arhivirano iz prvotnega spletišča dne 25. decembra 2018. Pridobljeno 9. junija 2009.
- ↑ »Letno poročilo o kakovosti pitne vode za leto 2020« (PDF). Ministrstvo za zdravje. Junij 2021. Pridobljeno 7. junija 2022.
- ↑ Water Use in the United States. National Atlas.gov. Arhivirano 14. avgusta 2009 na Wayback Machine.
- ↑ »Material Safety Data Sheet: Quicklime« (PDF). Lhoist North America. 6. avgust 2012. Arhivirano (PDF) iz spletišča dne 5. julija 2016. Pridobljeno 24. oktobra 2019.
- ↑ Naumann d'Alnoncourt, Raoul; Csepei, Lénárd-István; Hävecker, Michael; Girgsdies, Frank; Schuster, Manfred E; Schlögl, Robert; Trunschke, Annette (2014). »The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts« (PDF). Journal of Catalysis. Zv. 311. str. 369–385. doi:10.1016/j.jcat.2013.12.008. hdl:11858/00-001M-0000-0014-F434-5. Arhivirano iz prvotnega spletišča (PDF) dne 15. februarja 2016. Pridobljeno 14. januarja 2018.
- ↑ Hävecker, Michael; Wrabetz, Sabine; Kröhnert, Jutta; Csepei, Lenard-Istvan; Naumann d'Alnoncourt, Raoul; Kolen'Ko, Yury V; Girgsdies, Frank; Schlögl, Robert; Trunschke, Annette (2012). »Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid« (PDF). Journal of Catalysis. Zv. 285. str. 48–60. doi:10.1016/j.jcat.2011.09.012. hdl:11858/00-001M-0000-0012-1BEB-F. Arhivirano iz prvotnega spletišča (PDF) dne 30. oktobra 2016. Pridobljeno 14. januarja 2018.
- ↑ Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts (PDF). 2011. Arhivirano (PDF) iz spletišča dne 20. decembra 2016. Pridobljeno 14. januarja 2018.
- ↑ Amakawa, Kazuhiko; Kolen'Ko, Yury V; Villa, Alberto; Schuster, Manfred E/; Csepei, Lénárd-István; Weinberg, Gisela; Wrabetz, Sabine; Naumann d'Alnoncourt, Raoul; Girgsdies, Frank; Prati, Laura; Schlögl, Robert; Trunschke, Annette (2013). »Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol«. ACS Catalysis. Zv. 3, št. 6. str. 1103–1113. doi:10.1021/cs400010q. Arhivirano iz spletišča dne 22. oktobra 2018. Pridobljeno 14. januarja 2018.
- ↑ Duff, Sister Loretto Basil (1916). A Course in Household Arts: Part I. Whitcomb & Barrows.
- ↑ 125,0 125,1 Vaclavik, Vickie A.; Christian, Elizabeth W. (2007). Essentials of Food Science. Springer. ISBN 978-0-387-69939-4.
- ↑ 126,0 126,1 DeMan, John M. (1999). Principles of Food Chemistry. Springer. ISBN 978-0-8342-1234-3.
- ↑ »Map showing the rate of hardness in mg/l as Calcium carbonate in England and Wales« (PDF). DEFRA/ Drinking Water Inspectorate. 2009. Arhivirano (PDF) iz spletišča dne 29. maja 2015. Pridobljeno 18. maja 2015.
- ↑ »Water hardness«. US Geological Service. 8. april 2014. Arhivirano iz spletišča dne 18. maja 2015. Pridobljeno 18. maja 2015.
- ↑ Mekonnen, M.M.; Hoekstra, A.Y. (december 2010). »The green, blue and grey water footprint of farm animals and animal products, Value of Water Research Report Series No. 48 – Volume 1: Main report« (PDF). UNESCO – IHE Institute for Water Education. Arhivirano (PDF) iz spletišča dne 27. maja 2014. Pridobljeno 30. januarja 2014.
{{navedi splet}}: Vzdrževanje CS1: samodejni prevod datuma (povezava) - ↑ »WHO Model List of EssentialMedicines« (PDF). World Health Organization. Oktober 2013. Arhivirano (PDF) iz spletišča dne 23. aprila 2014. Pridobljeno 22. aprila 2014.
- ↑ »ALMA Greatly Improves Capacity to Search for Water in Universe«. Arhivirano iz spletišča dne 23. julija 2015. Pridobljeno 20. julija 2015.
- ↑ Melnick, Gary, Harvard-Smithsonian Center for Astrophysics, Neufeld, David, Johns Hopkins University citiran v: »Discover of Water Vapor Near Orion Nebula Suggests Possible Origin of H20 in Solar System (sic)«. The Harvard University Gazette. 23. april 1998. Arhivirano iz prvotnega spletišča dne 16. januarja 2000. »Space Cloud Holds Enough Water to Fill Earth's Oceans 1 Million Times«. Headlines@Hopkins, JHU. 9. april 1998. Arhivirano iz spletišča dne 9. novembra 2007. Pridobljeno 21. aprila 2007. »Water, Water Everywhere: Radio telescope finds water is common in universe«. The Harvard University Gazette. 25. februar 1999. Arhivirano iz spletišča dne 19. maja 2011. Pridobljeno 19. septembra 2010. (archive link)
- ↑ 133,0 133,1 Clavin, Whitney; Buis, Alan (22. julij 2011). »Astronomers Find Largest, Most Distant Reservoir of Water«. NASA. Arhivirano iz spletišča dne 24. julija 2011. Pridobljeno 25. julija 2011.
- ↑ 134,0 134,1 »Astronomers Find Largest, Oldest Mass of Water in Universe«. Space.com. 22. julij 2011. Arhivirano iz spletišča dne 29. oktobra 2011. Pridobljeno 23. julija 2011.
- ↑ Bova, Ben (13. oktober 2009). Faint Echoes, Distant Stars: The Science and Politics of Finding Life Beyond Earth. Zondervan. ISBN 9780061854484.
- ↑ Solanki, S.K.; Livingston, W.; Ayres, T. (1994). »New Light on the Heart of Darkness of the Solar Chromosphere« (PDF). Science. Zv. 263, št. 5143. str. 64–66. Bibcode:1994Sci...263...64S. doi:10.1126/science.263.5143.64. PMID 17748350. S2CID 27696504. Arhivirano iz prvotnega spletišča (PDF) dne 7. marca 2019.
- ↑ »MESSENGER Scientists 'Astonished' to Find Water in Mercury's Thin Atmosphere«. Planetary Society. 3. julij 2008. Arhivirano iz prvotnega spletišča dne 6. aprila 2010. Pridobljeno 5. julija 2008.
- ↑ Bertaux, Jean-Loup; Vandaele, Ann-Carine; Korablev, Oleg; Villard, E.; Fedorova, A.; Fussen, D.; Quémerais, E.; Belyaev, D.; in sod. (2007). »A warm layer in Venus' cryosphere and high-altitude measurements of HF, HCl, H2O and HDO«. Nature. Zv. 450, št. 7170. str. 646–649. Bibcode:2007Natur.450..646B. doi:10.1038/nature05974. PMID 18046397. S2CID 4421875.
- ↑ Sridharan, R.; Ahmed, S.M.; Dasa, Tirtha Pratim; Sreelathaa, P.; Pradeepkumara, P.; Naika, Neha; Supriya, Gogulapati (2010). »'Direct' evidence for water (H2O) in the sunlit lunar ambience from CHACE on MIP of Chandrayaan I«. Planetary and Space Science. Zv. 58, št. 6. str. 947. Bibcode:2010P&SS...58..947S. doi:10.1016/j.pss.2010.02.013.
- ↑ Rapp, Donald (28. november 2012). Use of Extraterrestrial Resources for Human Space Missions to Moon or Mars. Springer. str. 78. ISBN 978-3-642-32762-9. Arhivirano iz spletišča dne 15. julija 2016. Pridobljeno 9. februarja 2016.
- ↑ Küppers, M.; O'Rourke, L.; Bockelée-Morvan, D.; Zakharov, V.; Lee, S.; Von Allmen, P.; Carry, B.; Teyssier, D.; Marston, A.; Müller, T.; Crovisier, J.; Barucci, M.A.; Moreno, R. (23. januar 2014). »Localized sources of water vapour on the dwarf planet (1) Ceres«. Nature. Zv. 505, št. 7484. str. 525–527. Bibcode:2014Natur.505..525K. doi:10.1038/nature12918. PMID 24451541. S2CID 4448395.
- ↑ Atreya, Sushil K.; Wong, Ah-San (2005). »Coupled Clouds and Chemistry of the Giant Planets A Case for Multiprobes« (PDF). Space Science Reviews. Zv. 116, št. 1–2. str. 121–136. Bibcode:2005SSRv..116..121A. doi:10.1007/s11214-005-1951-5. hdl:2027.42/43766. S2CID 31037195. Arhivirano (PDF) iz spletišča dne 22. julija 2011. Pridobljeno 1. aprila 2014.
- ↑ Cook, Jia-Rui C.; Gutro, Rob; Brown, Dwayne; Harrington, J.D.; Fohn, Joe (12. december 2013). »Hubble Sees Evidence of Water Vapor at Jupiter Moon«. NASA. Arhivirano iz spletišča dne 15. decembra 2013. Pridobljeno 12. decembra 2013.
- ↑ Hubbard, W.B. (1997). »Neptune's Deep Chemistry«. Science. Zv. 275, št. 5304. str. 1279–1280. doi:10.1126/science.275.5304.1279. PMID 9064785. S2CID 36248590.
- ↑ Water Found on Distant Planet Arhivirano 16. julija 2007 na Wayback Machine. 12. julija 2007 by Laura Blue, Time
- ↑ Water Found in Extrasolar Planet's Atmosphere Arhivirano 30. december 2010 na Wayback Machine. – Space.com
- ↑ Lockwood, Alexandra C; Johnson, John A; Bender, Chad F; Carr, John S; Barman, Travis; Richert, Alexander J.W.; Blake, Geoffrey A (2014). »Near-IR Direct Detection of Water Vapor in Tau Boo B«. The Astrophysical Journal. Zv. 783, št. 2. str. L29. arXiv:1402.0846. Bibcode:2014ApJ...783L..29L. doi:10.1088/2041-8205/783/2/L29. S2CID 8463125.
- ↑ Clavin, Whitney; Chou, Felicia; Weaver, Donna; Villard; Johnson, Michele (24. september 2014). »NASA Telescopes Find Clear Skies and Water Vapor on Exoplanet«. NASA. Arhivirano iz spletišča dne 14. januarja 2017. Pridobljeno 24. septembra 2014.
- ↑ 149,0 149,1 Hanslmeier, Arnold (29. september 2010). Water in the Universe. Springer Science & Business Media. str. 159–. ISBN 978-90-481-9984-6. Arhivirano iz spletišča dne 15. julija 2016. Pridobljeno 9. februarja 2016.
- ↑ »Hubble Traces Subtle Signals of Water on Hazy Worlds«. NASA. 3. december 2013. Arhivirano iz spletišča dne 6. decembra 2013. Pridobljeno 4. decembra 2013.
- ↑ Water Found on Distant Planet Arhivirano 16. julija 2007 na Wayback Machine. 12. julija 2007 By Laura Blue, Time
- ↑ Andersson, Jonas (junij 2012). Water in stellar atmospheres "Is a novel picture required to explain the atmospheric behavior of water in red giant stars?" Arhivirano 13. februarja 2015 na Wayback Machine. Lund Observatory, Lund University, Sweden
- ↑ Arnold Hanslmeier (29. september 2010). Water in the Universe. Springer Science & Business Media. str. 159–.ISBN 978-90-481-9984-6. Arhivirano iz zvirnika 15. julija 2016. Pridovljeno 9- februarja 2016.
- ↑ »Herschel Finds Oceans of Water in Disk of Nearby Star«. NASA. 20. oktober 2011. Arhivirano iz prvotnega spletišča dne 19. februarja 2015. Pridobljeno 28. septembra 2015.
- ↑ Lloyd, Robin (11. julij 2001). »Water Vapor, Possible Comets, Found Orbiting Star«. Space.com. Arhivirano iz prvotnega spletišča dne 23. maja 2009. Pridobljeno 15. decembra 2006.
- ↑ »NASA Confirms Evidence That Liquid Water Flows on Today's Mars«. NASA. 28. september 2015. Pridobljeno 22. junija 2020.
- ↑ Platt, Jane; Bell, Brian (3. april 2014). »NASA Space Assets Detect Ocean inside Saturn Moon«. NASA. Arhivirano iz spletišča dne 3. aprila 2014. Pridobljeno 3. aprila 2014.
- ↑ Iess, L.; Stevenson, D. J.; Parisi, M.; Hemingway, D.; Jacobson, R.A.; Lunine, Jonathan I.; Nimmo, F.; Armstrong, J. W.; Asmar, S. W.; Ducci, M.; Tortora, P. (4. april 2014). »The Gravity Field and Interior Structure of Enceladus« (PDF). Science. Zv. 344, št. 6179. str. 78–80. Bibcode:2014Sci...344...78I. doi:10.1126/science.1250551. PMID 24700854. S2CID 28990283. Arhivirano (PDF) iz spletišča dne 2. decembra 2017. Pridobljeno 14. julija 2019.
- ↑ Dunaeva, A.N.; Kronrod, V.A.; Kuskov, O.L. (2013). »Numerical Models of Titan's Interior with Subsurface Ocean« (PDF). 44th Lunar and Planetary Science Conference (2013). Št. 1719. str. 2454. Bibcode:2013LPI....44.2454D. Arhivirano (PDF) iz spletišča dne 23. marca 2014. Pridobljeno 23. marca 2014.
- ↑ Tritt, Charles S. (2002). »Possibility of Life on Europa«. Milwaukee School of Engineering. Arhivirano iz prvotnega spletišča dne 9. junija 2007. Pridobljeno 10. avgusta 2007.
- ↑ Dunham, Will (3. maj 2014). »Jupiter's moon Ganymede may have 'club sandwich' layers of ocean«. Reuters. Arhivirano iz prvotnega spletišča dne 3. maja 2014. Pridobljeno 28. septembra 2015.
- ↑ Carr, M.H. (1996). Water on Mars. New York: Oxford University Press. str. 197.
- ↑ Bibring, J.-P.; Langevin, Yves; Poulet, François; Gendrin, Aline; Gondet, Brigitte; in sod. (2004). »Perennial Water Ice Identified in the South Polar Cap of Mars«. Nature. Zv. 428, št. 6983. str. 627–630. Bibcode:2004Natur.428..627B. doi:10.1038/nature02461. PMID 15024393. S2CID 4373206.
- ↑ Versteckt in Glasperlen: Auf dem Mond gibt es Wasser – Wissenschaft – Arhivirano 10. julija 2008 na Wayback Machine. Der Spiegel – Nachrichten
- ↑ Water Molecules Found on the Moon Arhivirano 27. septembra 2009 na Wayback Machine., NASA, 24. septembra
- ↑ McCord, T.B.; Sotin, C. (21. maj 2005). »Ceres: Evolution and current state«. Journal of Geophysical Research: Planets. Zv. 110, št. E5. str. E05009. Bibcode:2005JGRE..110.5009M. doi:10.1029/2004JE002244.
- ↑ Thomas, P.C.; Parker, J.Wm.; McFadden, L.A.; in sod. (2005). »Differentiation of the asteroid Ceres as revealed by its shape«. Nature. Zv. 437, št. 7056. str. 224–226. Bibcode:2005Natur.437..224T. doi:10.1038/nature03938. PMID 16148926. S2CID 17758979.
- ↑ Carey, Bjorn (7. september 2005). »Largest Asteroid Might Contain More Fresh Water than Earth«. SPACE.com. Arhivirano iz spletišča dne 18. decembra 2010. Pridobljeno 16. avgusta 2006.
- ↑ Chang, Kenneth (12. marec 2015). »Suddenly, It Seems, Water Is Everywhere in Solar System«. New York Times. Arhivirano iz spletišča dne 12. avgusta 2018. Pridobljeno 12. marca 2015.
- ↑ Kuskov, O.L.; Kronrod, V.A. (2005). »Internal structure of Europa and Callisto«. Icarus. Zv. 177, št. 2. str. 550–369. Bibcode:2005Icar..177..550K. doi:10.1016/j.icarus.2005.04.014.
- ↑ Showman, A. P.; Malhotra, R. (1. oktober 1999). »The Galilean Satellites« (PDF). Science. Zv. 286, št. 5437. str. 77–84. doi:10.1126/science.286.5437.77. PMID 10506564. S2CID 9492520. Arhivirano iz prvotnega spletišča (PDF) dne 12. aprila 2020.
- ↑ 172,0 172,1 Sparrow, Giles (2006). The Solar System. Thunder Bay Press. ISBN 978-1-59223-579-7.
- ↑ Tobie, G.; Grasset, Olivier; Lunine, Jonathan I.; Mocquet, Antoine; Sotin, Christophe (2005). »Titan's internal structure inferred from a coupled thermal-orbital model«. Icarus. Zv. 175, št. 2. str. 496–502. Bibcode:2005Icar..175..496T. doi:10.1016/j.icarus.2004.12.007.
- ↑ Verbiscer, A.; French, R.; Showalter, M.; Helfenstein, P. (9. februar 2007). »Enceladus: Cosmic Graffiti Artist Caught in the Act«. Science. Zv. 315, št. 5813. str. 815. Bibcode:2007Sci...315..815V. doi:10.1126/science.1134681. PMID 17289992. S2CID 21932253. (supporting online material, table S1)
- ↑ Greenberg, J. Mayo (1998). »Making a comet nucleus«. Astronomy and Astrophysics. Zv. 330. str. 375. Bibcode:1998A&A...330..375G.
- ↑ »Dirty Snowballs in Space«. Starryskies. Arhivirano iz prvotnega spletišča dne 29. januarja 2013. Pridobljeno 15. avgusta 2013.
- ↑ E.L. Gibb; M.J. Mumma; N. Dello Russo; M.A. DiSanti; K. Magee-Sauer (2003). »Methane in Oort Cloud comets«. Icarus. Zv. 165, št. 2. str. 391–406. Bibcode:2003Icar..165..391G. doi:10.1016/S0019-1035(03)00201-X.
- ↑ »MESSENGER Finds New Evidence for Water Ice at Mercury's Poles«. NASA. 29. november 2012. Arhivirano iz prvotnega spletišča dne 30. novembra 2012.
- ↑ Thomas, P.C.; Burns, J.A.; Helfenstein, P.; Squyres, S.; Veverka, J.; Porco, C.; Turtle, E.P.; McEwen, A.; Denk, T.; Giesef, B.; Roatschf, T.; Johnsong, T.V.; Jacobsong, R.A. (Oktober 2007). »Shapes of the saturnian icy satellites and their significance« (PDF). Icarus. Zv. 190, št. 2. str. 573–584. Bibcode:2007Icar..190..573T. doi:10.1016/j.icarus.2007.03.012. Arhivirano (PDF) iz spletišča dne 27. septembra 2011. Pridobljeno 15. decembra 2011.
- ↑ Weird water lurking inside giant planets Arhivirano 15. april 2015 na Wayback Machine., New Scientist, 1. september 2010, Magazine issue 2776.
- ↑ Dooge, J.C.I. (2001). »Integrated Management of Water Resources«. V Ehlers, E.; Krafft, T (ur.). Understanding the Earth System: compartments, processes, and interactions. Springer. str. 116.
- ↑ »Habitable Zone«. The Encyclopedia of Astrobiology, Astronomy and Spaceflight. Arhivirano iz spletišča dne 23. maja 2007. Pridobljeno 26. aprila 2007.
- ↑ Shiga, David (6. maj 2007). »Strange alien world made of "hot ice"«. New Scientist. Arhivirano iz prvotnega spletišča dne 6. julija 2008. Pridobljeno 28. marca 2010.
- ↑ Aguilar, David A. (16. december 2009). »Astronomers Find Super-Earth Using Amateur, Off-the-Shelf Technology«. Harvard-Smithsonian Center for Astrophysics. Arhivirano iz spletišča dne 7. aprila 2012. Pridobljeno 28. marca 2010.
- ↑ Bregač, Miha; Gril, Maša; Košir, Tina; Zupančič, Simona; Pucelj Vidović, Tanja; Kovič Dine, Maša; Vrbica, Senka (2015). Odgovornost države zagotavljati pravico do čiste pitne vode (PDF). Ljubljana: Pravna klinika za varstvo okolja. ISBN 978-961-6447-52-2. OCLC 922864579.
- ↑ »Pravica do pitne vode je v ustavi«. Delo. 16. november 2016. Pridobljeno 19. aprila 2022.
- ↑ 187,0 187,1 »MDG Report 2008« (PDF). Organizacija združenih narodov. Arhivirano (PDF) iz spletišča dne 27. avgusta 2010. Pridobljeno 25. julija 2010.
- ↑ Kulshreshtha, S.N (1998). »A Global Outlook for Water Resources to the Year 2025«. Water Resources Management. Zv. 12, št. 3. str. 167–184. doi:10.1023/A:1007957229865. S2CID 152322295.
- ↑ The Millennium Development Goals Report. Arhivirano 27. avgusta 2010 na Wayback Machine.
- ↑ Lomborg, Björn (2001). The Skeptical Environmentalist (PDF). Cambridge University Press. str. 22. ISBN 978-0-521-01068-9. Arhivirano iz prvotnega spletišča (PDF) dne 25. julija 2013.
- ↑ Water, a shared responsibility. The United Nations World Water Development Report 2. UNESCO. 2006. Arhivirano iz prvotnega spletišča dne 6. januar 2009. https://web.archive.org/web/20090106144926/http://unesdoc.unesco.org/images/0014/001444/144409E.pdf.
- ↑ Z. Wahrman, Miryam (2016). The Hand Book: Surviving in a Germ-Filled World. University Press of New England. str. 46-48. ISBN 9781611689556.
- ↑ Chambers's encyclopædia, Lippincott & Co (1870). str. 394.
- ↑ Altman, Nathaniel (2002). Sacred water: the spiritual source of life. str. 130–133. ISBN 1-58768-013-0.
- ↑ »ĀB i. The concept of water in ancient Iran – Encyclopaedia Iranica«. www.iranicaonline.org (v angleščini). Encyclopedia Iranica. Arhivirano iz spletišča dne 16. maja 2018. Pridobljeno 19. septembra 2018.
- ↑ Lindberg, D. (2008). The beginnings of western science: The European scientific tradition in a philosophical, religious, and institutional context, prehistory to A.D. 1450 (2. izd.). Chicago: University of Chicago Press.
- ↑ »Internet Sacred Text Archive Home«. Sacred-texts.com. Arhivirano iz spletišča dne 12. julija 2010. Pridobljeno 25. julija 2010.
- ↑ Guanzi: Shui Di – Chinese Text Project Arhivirano 6. novembra 2014 at Archive.is. Ctext.org. Pridobljeno 28. septembra 2015.
- ↑ Vartanian, Hrag (3. oktober 2011). »Manhattan Cathedral Explores Water in Art«. Hyperallergic. Pridobljeno 14. decembra 2020.
- ↑ Rev. Dr. A. Kowalski, James (6. oktober 2011). »The Cathedral of St. John the Divine and The Value of Water«. huffingtonpost.com. Huffington Post. Pridobljeno 14. decembra 2020.
- ↑ Foster, Fredericka. »The Value of Water at St John the Divine«. vimeo.com. Sara Karl. Pridobljeno 14. decembra 2020.
- ↑ Miller, Reverend Canon, Tom. »The Value of Water Exhibition«. UCLA Art Science Center. Pridobljeno 14. decembra 2020.
- ↑ Madel, Robin (6. december 2017). »Through Art, the Value of Water Expressed«. Huffington Post. Pridobljeno 16. decembra 2020.
- ↑ Cotter, Mary (4. oktober 2011). »Manhattan Cathedral Examines "The Value of Water" in a New Star-Studded Art Exhibition«. inhabitat.com. inhabitat. Pridobljeno 14. decembra 2020.
- ↑ »Influential Figures Dr. Charlotte Cote«. tseshaht.com. Tseshaht First Nation [c̓išaaʔatḥ]. Pridobljeno 19. avgusta 2021.
- ↑ »10 years of the human rights to water and sanitation«. Organizacija združenih narodov. Un - Water Family News. 27. februar 2020. Pridobljeno 19. avgusta 2021.
- ↑ »Water is sacred': 10 visual artists reflect on the human right to water«. The Guardian. 4. avgust 2020. Pridobljeno 19. avgusta 2021.
- ↑ »dihydrogen monoxide«. dictionary.com. Arhivirano iz spletišča dne 2. maja 2018. Pridobljeno 19. aprila 2022.
- ↑ Kolar, Lana (2. april 2006). »Šund znanost: Nevarni dihidrogen monoksid«. Kvarkadabra. Pridobljeno 19. aprila 2022.
Viri
[uredi | uredi kodo]- Ball, Philip (2001). Life's matrix : a biography of water (1. izd.). Farrar, Straus, and Giroux. ISBN 9780520230088.
- Franks, Felix (2007). Water : a matrix of life (2. izd.). Royal Society of Chemistry. ISBN 9781847552341.
- Lide, D.R., ur. (2003). »Dissociation constants of organic acids and bases«. CRC Handbook of Chemistry and Physics (84. izd.). Boca Raton: CRC Press.
- Reece, Jane B. (2013). Campbell Biology (10. izd.). Pearson. ISBN 9780321775658.
Glej tudi
[uredi | uredi kodo]Zunanje povezave
[uredi | uredi kodo]V slovenščini:
V drugih jezikih:
- Lower S. Voda in njena struktura. (angleško)
- OECD Water statistics
- The World's Water Data Page
- FAO Comprehensive Water Database, AQUASTAT
- The Water Conflict Chronology: Water Conflict Database Arhivirano 2013-01-16 na Wayback Machine.
- Water science school (USGS)
- Portal o vodi (Svetovna banka)
- America Water Resources Association Arhivirano 24. marec 2018 na Wayback Machine.
- Water on the web
- Water structure and science Arhivirano 28. december 2014 na Wayback Machine.
- Why water is one of the weirdest things in the universe BBC Ideas, Video, 3:16 minut, 2019
- The chemistry of water Arhivirano 2020-06-19 na Wayback Machine. (NSF special report)
- The International Association for the Properties of Water and Steam
- H2O:The Molecule That Made Us, dokumentarec PBS (2020)