Bikarbonat
| |

| |
| Imena | |
|---|---|
| Sistematično ime
Hidroksidodioksidokarbonat(1−)[1] | |
| Druga imena
Hidrogenkarbonat[1]
| |
| Identifikatorji | |
3D model (JSmol)
|
|
| 3DMet | |
| 3903504 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| Gmelin | 49249 |
| KEGG | |
PubChem CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Lastnosti | |
| HCO− 3 | |
| Molska masa | 61,0168 g mol−1 |
| log P | −0,82 |
| Kislost (pKa) | 10,3 (konjugirana kislina karbonata) |
| Bazičnost (pKb) | 7,7 (konjugirana baza ogljikove kisline) |
Če ni navedeno drugače, podatki veljajo za material v standardnem stanju pri 25 °C, 100 kPa). | |
| Sklici infopolja | |
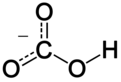
V anorganski kemiji je bíkarbonát (po IUPAC priporočljiva nomenklatura: hidrogenkarbonat[2]) je vmesna oblika v deprotonaciji ogljikove kisline. Gre za večatomski anion s kemijsko formulo HCO3–.
Bikarbonat ima ključno biokemijsko vlogo pri fiziološkem pH pufrskem sistemu.[3]
Izraz »bikarbonat« je 1814 skoval angleški kemik William Hyde Wollaston.[4] Predpona bi- v bikarbonatu izvira iz zastarelega sistema poimenovanja in temelji na opažanju, da je dvakrat toliko karbonata (CO2−
3) na en natrijev ion v natrijevem bikarbonatu (NaHCO3) in drugih bikarbonatih kot v natrijevem karbonatu (Na2CO3) in drugih karbonatih.[5] Ime se je ohranilo kot trivialno ime.
Kemijske lastnosti
[uredi | uredi kodo]Bikarbonatni ion (hidrogenkarbonatni ion) je anion z empirično formulo HCO−
3 in molekulsko maso 61,01 daltona; sestavlja ga osrednji ogljikov atom, obdan s tremi atomi kisika v trikotni planarni razporeditvi z vodikovim atomom, pritrjenim na enega od kisikov. Je izoelektronski z dušikovo kislino HNO3. Bikarbonatni ion ima negativen formalni naboj in je konjugirana baza ogljikove kisline H2CO3; istočasno pa je konjugirana kislina karbonatnega iona CO2−
3, kot prikazujejo spodnje ravnotežne reakcije:
- CO2−
3 + 2 H2O ⇌ HCO−
3 + H2O + OH− ⇌ H2CO3 + 2 OH−
- H2CO3 + 2 H2O ⇌ HCO−
3 + H3O+ + H2O ⇌ CO2−
3 + 2 H3O+.
Bikarbonatna sol nastane, ko se pozitivno nabit ion poveže z negativno nabitim atomom kisika v bikarbonatu, pri čemer nastane ionska spojina. Mnogo bikarbonatov je topnih v vodi pri standardnih temperaturi in tlaku; zlasti natrijev bikarbonat prispeva k skupno raztopljenim trdnim snovem, pogostemu parametru za ocenjevanje kakovosti vode.[navedi vir]
Fiziološka vloga
[uredi | uredi kodo]
Bikarbonat (HCO−
3) je alkalen in bistven za pH pufrski sistem človeškega telesa (vzdrževanje kislinsko-bazične homeostaze). 70–75 % CO2 v telesu se pretvori v ogljikovo kislino (H2CO3), ki se lahko hitro pretvori v bikarbonat.
Z ogljikovo kislino kot osrednjo intermediatno zvrstjo bikarbonat – v kombinaciji z vodo, vodikovimi ioni in ogljikovim dioksidom – tvori pufsrki sistem, ki se ohranja v hlapnem ravnotežju, da zagotovi takojšnjo odpornost na spremembe pH tako v kisli kot bazični smeri. To je še posebej pomembno za zaščito tkiv v centralnem živčnem sistemu, kjer so lahko velike spremembe pH katastrofalne (glej acidoza ali alkaloza).
Bikarbonat deluje tudi kot sredstvo za uravnavanje pH v tankem črevesu. Sprosti se iz trebušne slinavke v odgovor na hormon sekretin, da nevtralizira kisli himus, ki iz želodca vstopa v dvanajstnik.[6]
Bikarbonat v okolju
[uredi | uredi kodo]Bikarbonat je prevladujoča oblika raztopljenega anorganskega ogljika v morski vodi[7] in v večini sladkih voda. Kot tak je pomemben del ogljikovega cikla.
V sladkovodni ekologiji močna fotosintezna dejavnost sladkovodnih rastlin v dnevni svetlobi izpusti plinasti kisik v vodo, hkrati z njim pa tudi bikarbonate ione. Slednji dvignejo pH, včasih tudi do te mere, da v določenih okoliščinah stopnja alkalnosti za nekatere organizme postane strupena ali pa da druge raztopljene snovi, kot je amonijak, postanejo strupene. V temi, ko ne poteka fotosinteza, dihalni procesi proizvajajo ogljikov dioksid, ne pa tudi novih bikarbonatnih ionov, posledično pH hitro pade.
Druge uporabe
[uredi | uredi kodo]Najpogostejša sol bikarbonatnega iona je natrijev bikarbonat, NaHCO3, ki je splošno znan kot pecilni prašek. Ko se segreje ali je izpostavljen kislini, kot je ocetna kislina (kis), natrijev bikarbonat proizvaja ogljikov dioksid. Ta se uporablja kot sredstvo za vzhajanje v peki.
Pretok bikarbonatnih ionov iz kamnin, preperelih zaradi ogljikove kisline v dežni vodi, je pomemben del ogljikovega cikla.
Bikarbonat služi tudi v prebavnem sistemu. Dviguje notranji pH želodca po tem, ko zelo kisli prebavni sokovi končajo prebavljanje hrane. Amonijev bikarbonat se uporablja pri proizvodnji piškotov digestive.
Diagnostika
[uredi | uredi kodo]V diagnostični medicini je krvna vrednost bikarbonata eden od mnogih kazalnikov stanja kislinsko-bazične fiziologije telesa. Meri se skupaj z ogljikovim dioksidom, kloridom, kalijem, natrijem, da se oceni elektrolitna raven v elektrolitnem panelnem testu.
Parameter standardna koncentracija bikarbonata (SBCe) je koncentracija bikarbonata v krvi pri paCO2 40 mmHg (5,33 kPa), polni nasičenosti kisika in 36 °C.[6]

Bikarbonatne spojine
[uredi | uredi kodo]- Natrijev bikarbonat
- Kalijev bikarbonat
- Cezijev bikarbonat
- Magnezijev bikarbonat
- Kalcijev bikarbonat
- Amonijev bikarbonat
- Ogljikova kislina
Glej tudi
[uredi | uredi kodo]Viri
[uredi | uredi kodo]- ↑ 1,0 1,1 »hydrogencarbonate (CHEBI:17544)«. Chemical Entities of Biological Interest (ChEBI). UK: European Institute of Bioinformatics. IUPAC Names.
- ↑ Nomenclature of Inorganic Chemistry IUPAC Recommendations 2005 (PDF), IUPAC, str. 137
- ↑ »Clinical correlates of pH levels: bicarbonate as a buffer«. Biology.arizona.edu. Oktober 2006.
- ↑ William Hyde Wollaston (1814) "A synoptic scale of chemical equivalents," Philosophical Transactions of the Royal Society, 104: 1-22. On page 11, Wollaston coins the term "bicarbonate": "The next question that occurs relates to the composition of this crystallized carbonate of potash, which I am induced to call bi-carbonate of potash, for the purpose of marking more decidedly the distinction between this salt and that which is commonly called a subcarbonate, and in order to refer at once to the double dose of carbonic acid contained in it."
- ↑ »arhivska kopija«. Arhivirano iz prvotnega spletišča dne 26. februarja 2015. Pridobljeno 28. novembra 2017.
- ↑ 6,0 6,1 Acid Base Balance (page 3) Arhivirano 2002-06-13 na Wayback Machine.
- ↑ »The chemistry of ocean acidification : OCB-OA«. www.whoi.edu (v angleščini). Woods Hole Oceanographic Institution. 24. september 2012. Pridobljeno 17. maja 2017.
